Esercizio 20
Volendo produrre del gas esilarante N2O
dalla decomposizione di NH4NO3 secondo la secondo
la reazione:
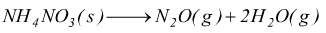
Determina il calore della reazione, sapendo che il calore di formazione
di NH4NO3 è -365,6 kJ/mole, il calore di formazione
di N2O è 82,05 kJ/mole mentre per l'acqua allo stato aeriforme
è -241,818 kJ/mole. :
[40kJ]
 edutecnica
edutecnica