Termochimica
Si è già visto in precedenza come la quantità di calore ( kJ o kcal ) acquisita o perduta da un corpo durante una trasformazione termodinamica è rappresentata dalla relazione:
![]()
dove Q è la quantità di calore espressa in Joule ( o calorie: 1 cal=4,186 J ); m è la massa del corpo in kg , Tf e Ti sono le temperature finale e iniziale della trasformazione, mentre con c viene indicato il calore specifico in J/kg°K; nel caso di solidi o liquidi è sottinteso si tratti del calore a specifico a pressione costante ( cp ) dato che nella generalità dei casi, lo scambio termico avviene a pressione atmosferica.
Il calore specifico di una sostanza è numericamente uguale alla quantità di kiloJoule ( o kilocalorie ) necessarie per innalzare di 1 grado, 1 kg di quella data sostanza.
Una tabella rappresentativa i calori specifici di varie sostanze è la seguente
| Sostanza | cp cal/g·°C (o kcal/kg·°K) | cp J/kg·°K |
| Alluminio | 0,21 | 879 |
| Argento | 0,057 | 239 |
| Rame | 0,092 | 385 |
| Zinco | 0,096 | 402 |
| Piombo | 0,031 | 130 |
| Ferro | 0,108 | 452 |
| Stagno | 0,057 | 239 |
| Bronzo | 0,091 | 381 |
| Ottone | 0,091 | 381 |
| Oro | 0,031 | 130 |
| Mercurio | 0,033 | 139 |
| Carbone vegetale | 0,263 | 1101 |
| Zolfo | 0,175 | 732 |
| Ghiaccio ( 0 °C) | 0,488 | 2043 |
| Acqua ( 0 °C) | 1,01 | 4228 |
| Acqua | 1 | 4186 |
| Acqua di mare | 0,95 | 3977 |
| Glicerolo | 0,572 | 2394 |
| Etanolo | 0,581 | 2432 |
| Benzina | 0,536 | 2244 |
| Olio lubrificante | 0,443 | 1854 |
| Petrolio | 0,455 | 1905 |
| Idrogeno | 3,419 | 14312 |
| Ossigeno | 0,2193 | 918 |
| Azoto | 0,248 | 1038 |
| Anidride carbonica | 0,2016 | 844 |
| Vapore d'acqua ( 100 °C) | 0,4454 | 1864 |
| Ammoniaca | 0,5004 | 2095 |
| Argo | 0,1244 | 521 |
| Aria | 0,240 | 1005 |
| Azoto | 0,2484 | 1040 |
| Elio | 1,2416 | 5197 |
| Metano | 0,5321 | 2227 |
| Propano | 0,3985 | 1668 |
La relazione precedente è valida solo se non
si ha una transizione di fase, altrimenti bisogna utilizzare il
calore latente λ per esprimere il calore scambiato.
Durante i passaggi di stato viene invece usata
la formula:
![]()
dove λ ( kcal/kg o kJ/kg ) è il calore latente (di fusione o di vaporizzazione a secondo dei casi).
Si ricorda come i passaggi di stato di una sostanza di vaporizzazione
e di fusione avvengono sempre a temperatura costante (temperatura di fusione
e di vaporizzazione).
La temperatura si mantiene costante, finché il passaggio di stato solido-liquido
o liquido-vapore non si è completato.
Il calore latente di fusione di un solido è
dunque, la quantità di calore necessaria per fondere 1 unità di massa
di quel solido, senza variazioni di temperatura.
Ad es. il calore di fusione del ghiaccio=80kcal/kg ( 0°C e 1 atm ) .
| Sostanza | Temperatura di fusione | Calore di Fusione | ||
| °C | K | kJ/Kg | kcal/kg | |
| Idrogeno | -259 | 14 | 58,6 | 13,99904 |
| Azoto | -210 | 63 | 25,5 | 6,091734 |
| Ossigeno | -219 | 54 | 13,8 | 3,296703 |
| Alcol etilico | -114 | 159 | 104 | 24,84472 |
| Mercurio | -39 | 234 | 11,8 | 2,81892 |
| Acqua | 0 | 273 | 334 | 79,78978 |
| Zolfo | 119 | 392 | 38 | 9,077879 |
| Piombo | 328 | 601 | 23 | 5,494505 |
| NaCl | 808 | 1081 | 500 | 119,4458 |
| Argento | 961 | 1234 | 109 | 26,03918 |
| Quarzo | 1607 | 1880 | 200 | 47,77831 |
Il calore latente di vaporizzazione di un liquido
è la quantità di calore necessaria per fondere 1 unità di massa di quel
liquido, senza variazioni di temperatura.
Ad es. il calore di vaporizzazione dell'acqua=538 kcal/kg ( 100°C e 1
atm ) .
| Sostanza | Temperatura di ebollizione |
Calore di Vaporizzazione
|
||
| °C | K | kJ/Kg | kcal/Kg | |
| Elio | -269 | 4 | 21 | 5,02 |
| Idrogeno | -253 | 20 | 452 | 107,98 |
| Azoto | -196 | 77 | 201 | 48,02 |
| Ossigeno | -183 | 90 | 213 | 50,88 |
| Etere etilico | 35 | 308 | 377 | 90,06 |
| Alcol etilico | 78 | 351 | 854 | 204,01 |
| Acqua | 100 | 373 | 2253 | 538,22 |
| Glicerina | 290 | 563 | 830 | 198,28 |
| Mercurio | 357 | 630 | 295 | 70,47 |
| Zolfo | 445 | 718 | 327 | 78,12 |
| Piombo | 1750 | 2023 | 871 | 208,07 |
| Argento | 2193 | 2466 | 2336 | 558,05 |
Entalpia di formazione
Quando un sistema assorbe calore, parte dell'energia assorbita può essere
usata per fornire lavoro mentre una parte viene trattenuta all'interno
del sistema stesso (come l'energia cinetica di atomi e molecole).
Questa energia trattenuta e denominata energia interna
U ed è funzione della temperatura del sistema U=U(T) .
L'entalpia H è una grandezza termodinamica
strettamente in relazione con l'energia interna
![]()
viene definita in modo tale che l'aumento di entalpia di un qualsiasi sistema, a pressione e volume costanti uguaglia esattamente il calore assorbito nel processo (viene ritenuto valido anche il caso in cui il lavoro compiuto dalla variazione di volume sia attribuibile alla sola dilatazione contro la pressione atmosferica).
Nonostante le condizioni possano sembrare fortemente restrittive, esse corrispondono approssimativamente a quelle in cui avvengono la maggior parte dei processi chimici, più precisamente:
Un processo endotermico
(nel quale il calore viene assorbito) ha un ΔH positivo (ΔH>0).
Un processo esotermico (nel quale il calore viene liberato) ha un ΔH
negativo (ΔH<0).
Un ΔH assegnato ad una equazione chimica definisce la variazione di entalpia che si verifica quando il numero di moli di ogni reagente impiegato è uguale al suo coefficiente nell'equazione bilanciata.
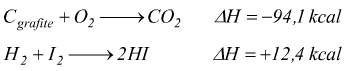
significa che vengono liberate 94,1 kcal quando si forma una mole di
CO2 dalla combinazione fra grafite e ossigeno, mentre 12,4
kcal vengono assorbite per formare 2 moli di HI dalla combinazione fra
idrogeno e iodio.
Vi sono convenzioni per le quali le equazioni termochimiche sono scritte
come se il calore fosse un prodotto o un reagente; secondo queste convenzioni
le due equazioni precedenti verrebbero scritte come:
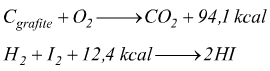
In valore assoluto il termine termico viene chiamato calore di reazione.
L'entalpia di formazione di una sostanza, viene indicata ΔHf
ed è l'entalpia che accompagna la formazione di una mole della sostanza
dai suoi elementi.
Si fa riferimento ad uno stato
standard per determinare l'entalpia di formazione che corrisponde
alla temperatura di 25°C. Di seguito le entalpie standard di formazione
per alcune sostanze.
|
Entalpie standard di formazione
|
|||
| sostanza | ΔHf (kcal/mol) | sostanza | ΔHf (kcal/mol) |
| Al2O3(s) | -399,1 | H2O(g) | -57,8 |
| B2O3(s) | -302 | H2O(l) | -68,32 |
| C(diamante) | +0,5 | H2O2(l) | -46 |
| CF4(g) | -163 | H2S(g) | -4,8 |
| CH3OH(g) | -48,1 | H2S(aq) | -9,4 |
| C9H20(l) | -65,8 | I2(g) | +14,9 |
| (CH3)2N2H2(l) | +54 | KCl(s) | -104,2 |
| C(NO2)4(l) | -8,8 | KClO3(s) | -93,5 |
| CO(g) | -26,4 | KClO4(s) | -104 |
| CO2(g) | -94,1 | LiAlH4(s) | -24 |
| CaC2(s) | -15 | LiBH4(s) | -45 |
| CaO(s) | -152 | Li2O(s) | -142 |
| Ca(OH)2(s) | -236 | NH3(l) | -16 |
| CaCO3(s) | -288,5 | NH4(l) | +12 |
| ClF3(l) | -42,7 | NO(g) | +21,6 |
| Cl-(aq) | -40 | NO2(g) | +12,4 |
| Cu2+(aq) | +15,4 | N2O4(g) | +2,3 |
| CuSO4(s) | -184 | N2O4(l) | -6,8 |
| F2O(l) | +3 | O3(g) | +34 |
| Fe2+(aq) | -21 | OH-(aq) | -54,96 |
| Fe2O3(s) | -196,5 | PCl3(g) | -73,2 |
| FeS(s) | -22,7 | PCl5(g) | -95,4 |
| H+(aq) | 0 | POCl3(g) | -141,5 |
| HCl(g) | -22,1 | SO2(g) | -71 |
| HF(g) | -64,2 | SO3(g) | -94,4 |
| HI(g) | +6,2 | Zn2+(aq) | -36,4 |
| HNO3(l) | -41 | AgCl(c) | -30,34 |
|
s=solido l=liquido
g=gas aq=soluzione acquosa c=cristallino
|
|||
Ricordiamo che tutti gli elementi nel loro stato standard, hanno zero
come valore di entalpia di formazione standard.
Una tabella piuttosto esauriente sui valori delle entalpie di formazione
è questa
.
Altre tabelle interessanti sono reperibili qui
e qui.
Legge di Hess (legge di additività delle entalpie)
In un processo chimico la variazione di entalpia H rimane la stessa,
sia che il processo si svolga in uno,
oppure più stadi, questo perché la variazione globale dipende solo dallo
stato iniziale e finale delle sostanze.
Ad esempio, considerando il fatto che è impossibile misurare il calore
liberato dal carbonio quando esso si trasforma in CO ( perché non si può
arrestare esattamente l'ossidazione a tale stadio ) .
Tuttavia si può determinare esattamente il calore di reazione per la combustione
di C in CO2
(che risulta -94,1 kcal/mol come si è visto) e anche il calore di combustione
del CO a CO2 ( - 67,7kcal/mol ).
L'entalpia di combustione da C a CO può dunque essere determinata sottraendo
dalla prima equazione la seconda come qui indicato:
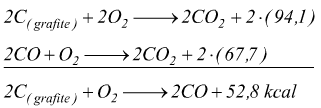
Dalla legge di Hess deriva la regola che afferma che la variazione di entalpia di qualsiasi reazione è uguale alla somma delle entalpie di formazione di tutti i prodotti meno la somma delle entalpie di formazione di tutti i reagenti.
![]()
 edutecnica
edutecnica