Termodinamica
L'entropia S è una misura del grado di disordine di un sistema: maggiore è il grado di disordine, maggiore è la sua entropia.
La prima legge della termodinamica, sostiene che in qualsiasi trasformazione l'energia non si crea né si distrugge.
La seconda legge della termodinamica afferma che ogni processo spontaneo è complessivamente accompagnato da un aumento di entropia e che i sistemi fisici evolvono spontaneamente verso lo stato a maggiore entropia. Dal punto di vista entropico una reazione chimica è spontanea quando avviene con un aumento di entropia.
Anche se le forme biologiche o gli automi ( i computers ad es. ) sembrano essere in grado di creare processi caratterizzati da 'ordine' questa apparente diminuzione di entropia è accompagnata da un aumento di entropia anche maggiore da qualche altra parte di conseguenza l'entropia dell'intero universo aumenta.
L'entropia standard (entropia assoluta) S° è, per definizione, l'entropia di una mole di sostanza in condizioni normali (25°C, 1 atm).
Osservando la tabella dei dati termodinamici si riconosce che:
•L'entropia standard di una sostanza in fase gassosa è più grande
dell'entropia standard della stessa sostanza in fase liquida.
• Tra due sostanze diverse nella stessa fase, quella a struttura
più complessa ha maggiore entropia (ad es. l'etano rispetto al metano).
• Se un elemento ha più forme allotropiche, quella più ordinata ha
entropia minore (ad es. il diamante rispetto la grafite) .
• Per le specie monoatomiche hanno maggior entropia le sostanze più
pesanti (ad es. il neon rispetto all'elio ) .
In termodinamica, l'universo è costituito da due cose:
1—il sistema
2—l'ambiente
Il sistema è l'oggetto sotto studio (in questo caso la reazione chimica
) l'ambiente è tutto il resto.
Sempre la seconda legge della termodinamica stabilisce che l'entropia dell'universo aumenta nel caso di un processo spontaneo mentre rimane invariata per un processo all'equilibrio.
![]() processo
spontaneo
processo
spontaneo
![]() processo
in equilibrio
processo
in equilibrio
Formalmente, la variazione di entropia è definita come il rapporto tra la quantità di calore scambiata in una trasformazione Q e la temperatura assoluta T del sistema:
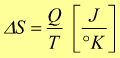
Conoscendo i valori dell'entropia standard di formazione S° di formazione dei composti è possibile calcolare l'entropia standard della reazione
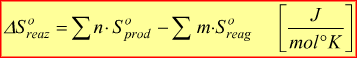
Dove n ed m sono i coefficienti stechiometrici dei composti coinvolti nel processo.
Nelle reazioni chimiche a pressione temperatura costante il calore Q ceduto o acquisito da un sistema è pari alla variazione di entalpia ΔH con
ΔH>0 per i processi endotermici (il sistema
assorbe calore dall'esterno)
ΔH<0 per i processi esotermici (il sistema rilascia calore all'esterno)
risulta dunque, che la variazione dell'entropia dell'ambiente è pari a:
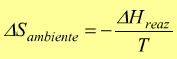
Il segno '—' indica che una variazione negativa di entalpia nel sistema ( reazione esotermica) corrisponde ad una variazione positiva di entropia nell'ambiente.
Ad esempio
Considerando la reazione in condizioni standard ( 25°C 1 atm )
![]()
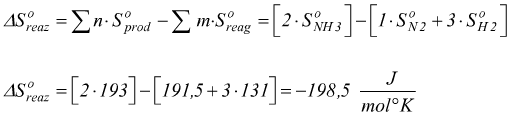
Poi per la legge di Hess
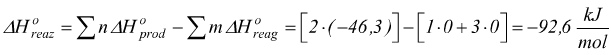
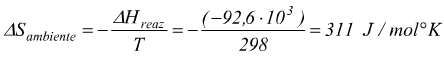
![]()
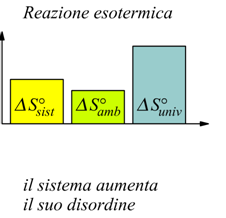
Il ΔSuniv è positiva, dunque la reazione sarò spontanea a 25°C.
Possono verificarsi vari casi, ma l'entropia dell'universo aumenta sempre.
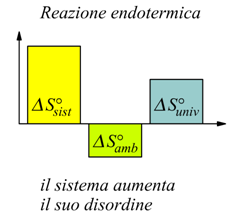

In generale né il fattore entalpico, né il fattore entropico, presi da soli, sono sufficienti per determinare la spontaneità di una reazione chimica. Si dimostra che durante una qualsiasi trasformazione spontanea devono verificarsi una variazione di entropia e una variazione di entalpia tali che risulti una diminuzione di una funzione di stato chiamata energia libera G (di Gibbs ) .
Legge di Gibbs
Si è visto prima che per un processo spontaneo
![]() con
con
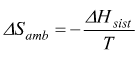 si
ha
si
ha
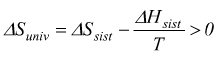 moltiplicando
per -T entrambi i membri
moltiplicando
per -T entrambi i membri
![]()
Per esprimere in modo più esplicito la spontaneità di un processo viene introdotta una funzione termodinamica nota come energia libera di Gibbs:
![]() in
termini di variazione ad una specifica temperatura:
in
termini di variazione ad una specifica temperatura:
![]()
L'equazione precedente permette di prevedere la spontaneità di un processo a secondo delle variazioni di entropia ed entalpia a temperatura e pressione costanti.
ΔG<0 la reazione diretta è spontanea (quella
inversa non è spontanea)
ΔG>0 la reazione diretta non è spontanea (quella inversa è spontanea)
ΔG=0 sistema all'equilibrio
L'energia libera standard di una reazione ΔG°reaz è la variazione di energia libera associata ad una reazione che avviene in condizioni standard ( 1 atm 25°C).
Considerando la generica reazione
![]()
La variazione dell'energia libera, in condizioni standard, per questa reazione vale
![]()
e più in generale
![]()
Quasi sempre la generica reazione
![]()
non avviene in condizioni standard ma il ΔG alle condizioni assegnate può essere ricavato dal ΔG° che è tabulato.
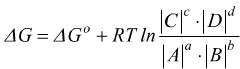 per
le soluzioni diluite con
per
le soluzioni diluite con
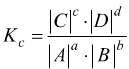
dove |A|, |B|,.. sono le concentrazioni.
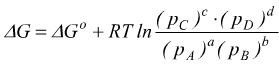 per
i gas ideali con
per
i gas ideali con 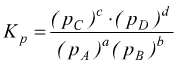
dove pA,pB .. sono le pressioni parziali dei vari gas;
Se ΔG<0 sarà spontanea la reazione diretta (quella che va da sinistra
verso destra).
Se la reazione è all'equilibrio ΔG=0 di conseguenza:
![]()
 edutecnica
edutecnica