Pile
Le pile chimiche sono dispositivi che convertono l'energia chimica in energia elettrica. Sono composte da due elettrodi immersi in una soluzione elettrolitica che permette il passaggio di ioni tra di essi, generando così una corrente elettrica.
Le pile chimiche sono utilizzate in molti dispositivi elettronici come batterie per alimentare telefoni cellulari, laptop, orologi e molti altri dispositivi portatili.
Quando si pone dello zinco metallico a contatto con una soluzione contenente ioni di rame, lo zinco si ossida a ioni Zn2+ mentre gli ioni Cu2+ si riducono a rame metallico. Secondo la reazione:
![]()
Bisogna ricordarsi che :
L'elemento che perde elettroni si ossida.
L'elemento che acquista elettroni si riduce.
Lo zinco perde elettroni dunque si ossida:
ossidazione: ![]()
Il rame acquista elettroni di conseguenza si riduce
riduzione: ![]()
Gli elettroni sono trasferiti direttamente in soluzione dal riducente
Zn all' agente ossidante Cu2+ ma se si riescono a separare
fisicamente le due semireazioni, si può fare in modo che gli elettroni
si muovano lungo un filo metallico per passare dallo Zn a Cu2+,
generando in questo modo una corrente elettrica.
L'apparato che sfrutta questo principio per generare elettricità viene
chiamato cella galvanica.
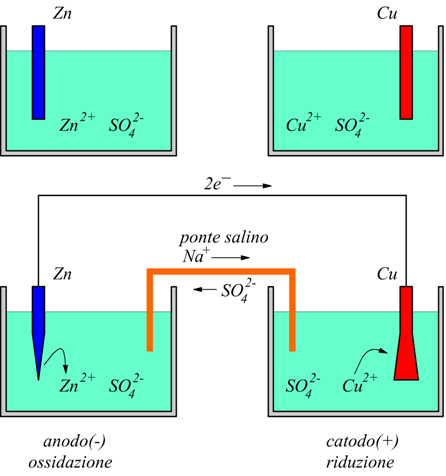
Una lamina di zinco è immersa in una soluzione acquosa di ZnSO4 all'interno di un contenitore mentre una lamina di rame è immersa in una soluzione acquosa di CuSO4 in un altro contenitore.
L'idea è quella di far avvenire simultaneamente, in zone separate l'ossidazione dello Zn a Zn2+ e la riduzione del Cu2+ a Cu facendo passare gli elettroni attraverso un cavo esterno.
Il circuito viene chiuso da un conduttore metallico che collega le due lamine chiamate elettrodi e da un un tubo a forma di U rovesciata disposto fra i due contenitori chiamato ponte salino contenente una soluzione di un elettrolita inerte ad es.KCl o Na2SO4 che ha la funzione di garantire l'elettroneutralità delle due soluzioni; infatti gli anioni Cl- o SO4- si spostano verso l'anodo per bilanciare l'accumulo di carica positiva e i cationi K+ o N+ si spostano verso il catodo per lo stesso analogo motivo.
Questo particolare combinazione di elettrodi ed elettroliti è noto come cella di Daniell e viene schematizzata con la scrittura:
![]()
La linea verticale singola rappresenta una variazione di fase mentre la doppia linea rappresenta il ponte salino. Per convenzione si deve scrivere l'anodo ( - ) a sinistra prima della doppia linea, poi il cadoto ( + ).
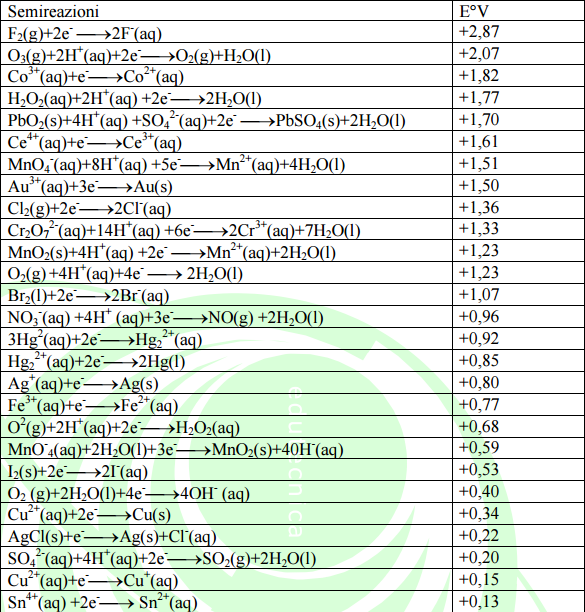
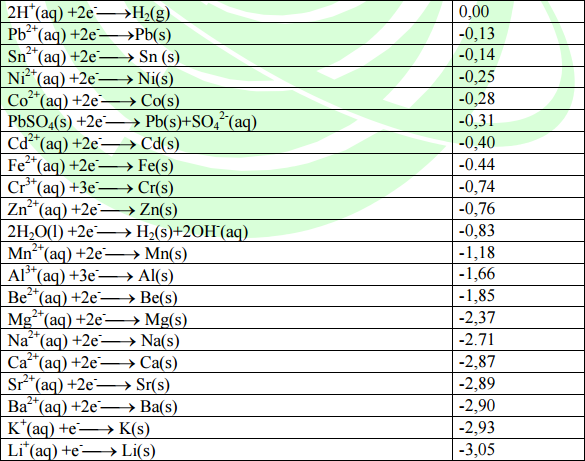
Le coppie redox ( scritte nel senso della reazione di riduzione ) vengono ordinate per potenziali di riduzione standard riportati in una tabella detta serie elettrochimica.
Noti potenziali di riduzione standard di due semicelle, si può calcolare
la forza elettromotrice standard
( f.e.m.) della pila, data dalla differenza tra i potenziali standard
di riduzione delle due semicelle.
![]()
Dalla tabella si osserva che l'elettrodo a idrogeno, ha potenziale standard di riduzione
![]()
esso è impiegato per determinare tutti gli altri potenziali elettronici e viene chiamato elettrodo standard ad idrogeno.
Come nel caso del ΔG il segno di E° può essere usato per capire se una reazione è spostata a destra o a sinistra. Un valore positivo di E° indica che la reazione favorirà la formazione dei prodotti mentre un valore negativo di E° indica che per l'equilibrio saranno favoriti i reagenti. Si nota, dalla tabella che per i componenti della pila di Daniell si ha:
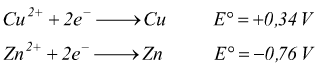
Il potenziale di riduzione maggiore ( Cu )corrisponderà
alla riduzione:catodo ( + ).
Il potenziale di riduzione minore ( Zn ) corrisponderà all'ossidazione:anodo
( - ).
Nella reazione redox complessiva, quest'ultima deve essere rappresentata
in direzione opposta:
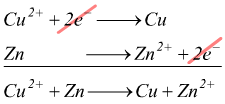
![]()
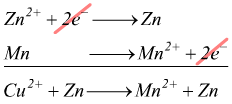
Se invece avessimo avuto una cella galvanica con una semicella Zn ed una Mn avremmo avuto:
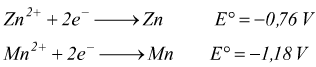
La reazione della semicella dello zinco ha il potenziale maggiore.
La semicella dello zinco corrisponde alla riduzione:catodo(+).
La semicella del manganese corrisponde all'ossidazione:anodo(-).
Quest'ultima deve essere rappresentata in direzione opposta nella reazione
redox complessiva:
![]()
Equazione di Nernst
L'equazione di Nernst permette di calcolare il potenziale di una cella in condizioni di concentrazione diversa da quella standard. Per una generica reazione redox:
![]()
L'equazione di Nernst è 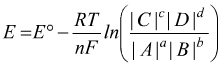
E=potenziale di cella in condizioni non standard
E°= potenziale standard di cella
R= costante universale dei gas
T= temperatura assoluta
n= numero di elettroni scambiati
F= costante di Faraday, che vale circa 96485 Coulomb/mole (carica portata
da una mole di elettroni).
Alla temperatura di 25°C il valore di RT/F=costante e trasformando il logaritmo naturale i logaritmo in base 10 ( con costante di conversione 2,3 ) l'equazione di Nernst diventa:
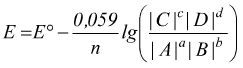
In condizioni di equilibrio si ha che la f.e.m. della pila e E=0; di conseguenza è possibile calcolare facilmente la relazione fra la costante di equilibrio e la f.e.m. in condizioni standard:
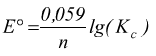
Potenziali standard di riduzione a 25°C
 edutecnica
edutecnica