Bilanciamenti
Per poter scrivere l'equazione chimica che corrisponde ad un determinato
processo si devono conoscere le formule di tutti i reagenti e di tutti
i prodotti della reazione.
Sapendo che il biossido di zolfo SO2 reagisce con l'acqua H2O
per formare l'acido solforoso H2SO3 si può scrivere:
![]()
che è di per sé una reazione già bilanciata; rispetta infatti il principio di conservazione della massa (legge di Lavoiser): il numero di atomi di ogni singolo elemento presente al primo membro deve rimanere invariato al secondo membro.
I coefficienti stechiometrici di una reazione di sintesi come la precedente o di dissociazione come la seguente:
![]()
o della reazione di scambio:
![]()
Possono semplicemente essere determinati con il conteggio degli atomi
degli elementi presenti. Per l'ultima equazione si nota che nella formula
di Na2CO3 sono presenti 2 atomi di Na, mentre in
NaCl è presente un solo atomo di Na.
Da qui la necessità del coefficiente stechiometrico 2 davanti ad NaCl.
Come conseguenza, a destra del segno di reazione, risultano ora presenti
2 atomi di Cl e quindi si deve scrivere il coefficiente 2 davanti al reagente
HCl. Il coefficiente di CO2 è 1 in quanto N2CO3
ha coefficiente 1 ed il coefficiente di H2O è 1., dato che
nei reagenti sono presenti 2 atomi di idrogeno (nelle 2 molecole di HCl).
Come controllo della corretta scelta dei coefficienti stechiometrici si
determina il numero totale di atomi di ossigeno nei reagenti (3 atomi
di ossigeno in N2CO3 ) che risulta uguale alla somma
degli atomi di ossigeno dei prodotti (2 atomi di ossigeno in una molecola
di CO2 a cui si addiziona 1 atomo di ossigeno in una molecola
di H2O).
Reazioni
Una reazione di ossido-riduzione è una reazione chimica in cui avviene il trasferimento di elettroni da una specie chimica all'altra.
Durante la reazione, una sostanza si ossida, perdendo elettroni, mentre un'altra si riduce, guadagnando elettroni. Questo tipo di reazione è anche chiamato reazione redox.
Le reazioni di ossido-riduzione sono comuni in molti processi chimici e biologici, tra cui la respirazione cellulare e la corrosione dei metalli.
Dunque, si dicono di ossido-riduzione quei processi che avvengono con trasferimento
di elettroni dalla sostanza che si ossida (perde elettroni) alla sostanza
che si riduce (acquista elettroni); la reazione
di ossidoriduzione si riconosce dunque, perché alcuni elementi dopo il
processo hanno variato il loro numero di ossidazione.
Nella reazione già vista sopra :
![]()
si nota come in nessuno degli elementi che appaiano vi sia una variazione del numero di ossidazione, ma se soltanto consideriamo la reazione:
![]()
si nota come sia l'ossigeno che l'idrogeno variano il loro numero di ossidazione
![]()
L'ossigeno acquista elettroni: si riduce. L'idrogeno perde elettroni: si ossida.
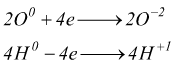
In linea generale le reazioni acido-base non sono redox, così come quelle
di dissoluzione, precipitazione e complessazione.
La maggior parte delle reazioni organiche non
sono redox.
Un gran numero di reazioni inorganiche sono
redox.
Per bilanciare alcune reazioni di ossidoriduzione come le seguenti,
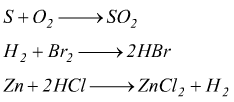
si può seguire la semplice procedura descritta per gli altri tipi di
equazioni, ma in linea generale il bilanciamento delle equazioni di ossidoriduzione
è più complicato e richiede di conoscenza di metodi particolari:
—Il metodo ionico-elettronico.
—Il metodo basato sul numero di ossidazione.
Metodo ionico-elettronico
(—1—) Si scrive uno schema
che comprenda quei reagenti e prodotti che contengono gli elementi soggetti
al cambiamento del numero di ossidazione.
(—2—) Si scrive uno schema
di equazione parziale per l'agente che si ossida, indicando che l'elemento
è passato ad un numero di ossidazione superiore a quello iniziale.
L'elemento non deve essere scritto sotto forma di atomo, o di ione libero,
a meno che non esista veramente in questa forma. Deve essere scritto come
parte di una specie reale molecolare o ionica.
(—3—) Si scrive un altro schema
di equazione parziale per l'agente che si riduce, indicando che l'elemento
passa ad un numero di ossidazione inferiore rispetto a quello iniziale.
(—4—) Si Bilancia ogni equazione
parziale rispetto al numero degli atomi di ogni elemento. In una soluzione
neutra od acida si aggiunge H2O ed H+ per bilanciare
gli atomi di ossigeno ed idrogeno (per primi si bilanciano gli atomi di
ossigeno).
Per ogni atomo di ossigeno in eccesso da una parte dell'equazione si assicura
il bilanciamento aggiungendo una molecola di H2O dall'altra
parte.
Quindi si aggiungono degli H+ per bilanciare l'idrogeno. (non
si usano mai molecole O2 ed H2 a meno che non si
sappia che che esse partecipano realmente in tale forma alla reazione).
Se la soluzione è alcalina si può usare OH-.
Per ogni ossigeno in eccesso da un lato dell'equazione , il bilanciamento
è assicurato aggiungendo una molecola di H2O dallo stesso lato
e 2OH- dall'altro.
Se poi l'idrogeno non è bilanciato, il bilanciamento è assicurato aggiungendo
un OH- per ogni idrogeno in eccesso dallo stesso lato dell'equazione
e un H2O dall'altro.
Se sia l'ossigeno che l'idrogeno sono in eccesso dalla stessa parte dell'equazione,
si può scrivere un OH- dall'altra parte per ogni H ed O in
eccesso.
(—5—) Se un elemento, soggetto
al cambiamento del numero di ossidazione , si trova in uno dei suoi stati
in un complesso con qualche altro elemento, bilanciare i gruppi che formano
il complesso con un atomo di quell'elemento, con lo stesso numero di ossidazione
in cui si trova nel complesso.
(—6—) Si bilancia ciascuna
equazione parziale rispetto al numero di cariche, aggiungendo elettroni
sia destra che a sinistra dell'equazione.
(—7—) Si moltiplica ciascuna
reazione parziale per un numero scelto in modo che il numero totale di
elettroni perduti dalla sostanza che si ossida sia uguale al numero di
elettroni acquistati dalla sostanza che si riduce.
(—8—) Si sommano le due
equazioni parziali che risultano dopo la moltiplicazione. Nell'equazione
somma cancellare i termini ad entrambe le parti. Gli elettroni devono
eliminarsi.
(—9—) Per i calcoli che
comprendono le masse dei reagenti e dei prodotti, occorre trasformare
l'equazione ionica ottenuta in una equazione molecolare.
Questo può essere fatto aggiungendo ad ogni membro dell'equazione numeri
uguali degli ioni che non sono soggetti a cambiamenti elettronici, ma
che sono presenti insieme ai componenti reattivi nelle sostanze chimiche
neutre. Si controlla nell'equazione finale il numero di atomi di ogni
elemento.
Metodo del numero di ossidazione
(—1—) Si scrive uno schema
di equazione che comprende i reagenti ed i prodotti soggetti al cambiamento
del numero di ossidazione.
(—2—) Si determina la variazione
del numero di ossidazione a cui è soggetta la sostanza che si riduce (acquista
elettroni). Il numero di elettroni ricevuti è uguale a tale variazione
moltiplicata per il numero di atomi che la subiscono.
(—3—) Fare la stessa cosa
per la sostanza che si ossida.
(—4—) Moltiplicare ciascuna
formula per numeri tali da rendere i numero di elettroni. acquistati dalla
sostanza che si riduce pari a quelli ceduti dalla sostanza che si ossida.
(—5—) Fornire coefficienti
appropriati al resto dell'equazione e controllare nell'equazione finale
il numero di atomi di ogni elemento.
Esempio:
![]()
Metodo ionico-elettronico
( 1 ) Lo schema dell'equazione precedente può essere riscritto.
![]()
per evidenziare meglio lo ione nitrato NO3-.
( 2 ) La sostanza che si riduce è lo ione NO3- ,
contiene N che è soggetto ad una diminuzione del numero di ossidazione.
La sostanza che si ossida è H2S perchè contiene S che aumenta
il suo numero di ossidazione.
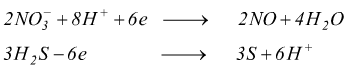
( 3 ) Lo schema dell'equazione parziale per la sostanza che si riduce:
![]()
( 4 ) Lo schema dell'equazione parziale per la sostanza che si ossida:
![]()
( 5 ) Nella prima equazione parziale occorre aggiungere 2H2O a destra per bilanciare gli atomi di ossigeno, mentre 4H+ deve essere aggiunto a sinistra per bilanciare gli atomi di idrogeno .
![]()
La seconda equazione parziale può essere bilanciata aggiungendo a destra 2H+.
![]()
( 6 ) Nella prima equazione parziale, la carica totale a sinistra è -1+4=+3 mentre a destra è zero. Occorre quindi aggiungere 3 elettroni a sinistra.
![]()
Nella seconda equazione parziale, la carica totale a sinistra è zero a destra +2. Devono essere aggiunti 2 elettroni a destra.
![]()
( 7 ) Per equilibrare gli elettroni la prima deve essere moltiplicata per 2 e la seconda per 3.
( 8 ) Dalla somma membro a membro delle due precedenti si ottiene:
![]() semplificando
gli H+.
semplificando
gli H+.
![]()
( 9 ) Se vogliamo sapere quanto HNO3 ci vuole dobbiamo combinare NO3- con H+.
![]()
Metodo del numero di ossidazione
![]()
( 1 ) L'azoto si riduce, lo zolfo si ossida
( 2 ) ![]()
( 3 ) ![]()
( 4 )
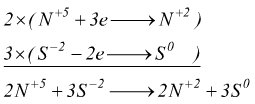
( 5 ) Quindi il coefficiente di NO e di HNO3 è 2 mentre quello di H2S e di S è 3.
![]()
poi si bilanciano gli ossigeni e gli idrogeni
![]()
Talvolta, per processi non particolarmente complessi, è possibile sottoporre la reazione a risolutori come questo o quello, ma poi il tutto va verificato sulla carta coi metodi precedentemente esposti.
Equazioni in forma ionica
Le equazioni che sono state viste erano tutte in forma molecolare, cioè
tutti i reagenti ed i prodotti compaiono con le formule chimiche complete,
elettricamente neutre.
Le equazioni. chimiche corrispondenti a reazioni che avvengono in solventi,
come l'acqua. sono scritte spesso in forma ionica.
In questo tipo di scrittura i reagenti ed i prodotti sono rappresentati
per mezzo degli ioni presenti nelle loro soluzioni, mentre continuano
ad essere rappresentate con le formule complete quelle specie chimiche
che sono insolubili, gassose e non dissociate nelle condizioni di reazione.
Ad esempio:
![]()
se scritta in forma ionica è
![]()
Il sale NH4HS sciolto in acqua si dissocia in NH+4
e HS-, mentre i prodotti NH3 ed H2S sono
sostanze gassose.
Anche le equazioni in forma ionica vengono risolte tramite i metodi precedentemente
visti, esse inoltre, devono soddisfare ,dopo il bilanciamento, sia
il principio di conservazione della massa che quello della carica elettrica,
cioè la somma algebrica delle cariche ioniche dei reagenti deve essere
uguale alla somma algebrica delle cariche ioniche dei prodotti.
 edutecnica
edutecnica