Elettrolisi
L'elettrolisi è un processo chimico in cui un'elettrodo positivo (anodo) e un'elettrodo negativo (catodo) vengono immersi in una soluzione elettrolitica e collegati a una fonte di energia elettrica.
Quando la corrente elettrica passa attraverso la soluzione, avviene una reazione chimica che porta alla separazione delle sostanze presenti nella soluzione.
Questo processo è utilizzato per la produzione di gas, metalli e altri composti chimici.
Nel caso di una pila, l'energia sviluppata di una reazione chimica viene trasformata in energia elettrica; il processo inverso è chiamato elettrolisi e in questo caso si impiega l'energia elettrica per far avvenire una reazione chimica di ossidoriduzione non spontanea.
Una celle elettrolitica è l'apparato nel quale far avvenire una elettrolisi. Nella cella è contenuta una soluzione elettrolitica o un elettrolita fuso.
L'esempio più semplice si può fare con del cloruro di sodio fuso, dove i cationi e gli anioni sono ioni Na+ e Cl- rispettivamente. La cella elettrolitica contiene una coppia di elettrodi connessi alla batteria. La batteria serve per spingere gli elettroni nella direzione in cui essi non fluirebbero spontaneamente.
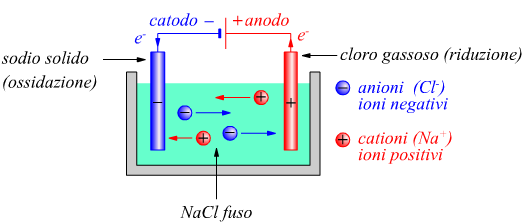
L'elettrodo verso cui vengono spinti gli elettroni è il catodo, dove
avviene la riduzione.
L'elettrodo dal quale gli elettroni vengono rimossi è l'anodo, dove
avviene l'ossidazione.
Le reazioni agli elettrodi sono:
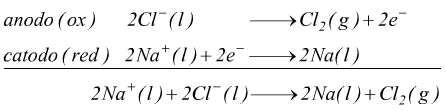
Attraverso questo processo si ottiene sodio metallico puro e cloro
gassoso.
Usando i dati della tabella
dei potenziali di riduzione si ha per questa reazione E°= – 4V.
Il potenziale di riduzione negativo indica che per far avvenire il processo
bisogna applicare almeno 4V di differenza di potenziale agli elettrodi,
poi in pratica ( come sempre ) bisogna applicare una d.d.p. anche maggiore
( sovratensione ) per compensare alle varie
inefficienze del dispositivo.
Chiaramente, ci sono sostanze che conducono facilmente l'elettricità
e altre meno.
Si fa quindi, una distinzione principale fra conduttori di prima specie
che seguono la legge di Ohm e quelli di seconda specie che non la seguono.
L'importante è superare la soglia di riduzione, altrimenti non si ha
elettrolisi.
Una volta che il processo è in marcia , possono essere applicate delle relazioni fra la quantità di elettricità che attraversa la cella elettrolitica e la quantità delle specie chimiche che si formano. Queste relazioni vanno sotto il nome di leggi di Faraday.
Prima legge di Faraday sull'elettrolisi
Le quantità di specie chimiche che si trasformano
agli elettrodi sono proporzionali alla quantità di carica elettrica
passata nella cella elettrolitica.
In un processo di elettrolisi la, corrente viene misurata in ampere che passa nella cella elettrolitica in un determinato intervallo di tempo . Ricordiamo la relazione fra carica e corrente :
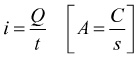
Seconda legge di Faraday sull'elettrolisi
Le quantità in grammi di specie diverse trasformate
agli elettrodi sono proporzionali alle loro masse equivalenti (pesi
equivalenti).
Nella pratica le leggi di Faraday si traducono nell'uso della seguente equazione:
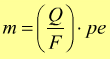 con
con 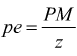
pe= peso equivalente
Q= quantità di carica
F= costante di Faraday, che vale circa 96485 Coulomb/mole (carica portata
da una mole di elettroni).
PM=peso molecolare
z=numero di elettroni trasferiti per ogni ione di sostanza
Elettrolisi dell'acqua
In condizioni normali (1 atm 25°C) l'acqua non si può decomporre per formare ossigeno ed idrogeno gassosi dato che per tale reazione la variazione di energia libera è positiva e molto alta.
![]()
Si può effettuare questa operazione usando una cella elettrolitica
in una soluzione 0,1M di H2SO4; questo perché
vi è una concentrazione ionica troppo bassa per consentire il passaggio
di elettricità.
Dopo aver avviato il processo, si potrà osservare la formazione
di bolle di gas su entrambi gli elettrodi sui quali avvengono i due
processi .
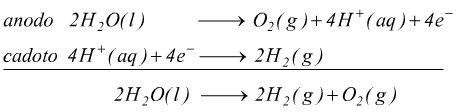
Esempio: una corrente di 1,76 A viene fatta passare attraverso una cella elettrolitica che contiene una soluzione di acido solforico diluito, per 7,44 h calcola il volume dei gas generati alla pressione di 1 atm e alla temperatura di 25 °C.
|
i= A |
|
|
t= h |
26784 sec |
|
p= atm |
101325 pa |
|
T= °C |
298 °K |
Q=t·i=47139 C
Ogni mole di ossigeno è associata a 4 elettroni 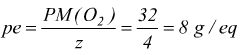
la massa di ossigeno prodotta: 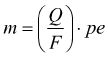 =3,9 g per
un totale di
=3,9 g per
un totale di 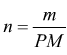 =0,12 moli
di O2
=0,12 moli
di O2
La semireazione dell'idrogeno indica che 2 moli di H2 coinvolgono
4 elettroni,
quindi 1 mole di H2 ne fa passare z=2
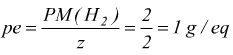
la massa di idrogeno prodotta: 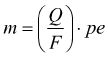 =0,48 g per
un totale di
=0,48 g per
un totale di 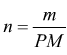 =0,24 moli
di H2
=0,24 moli
di H2
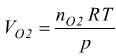 =2,71 l
di O2
=2,71 l
di O2
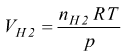 =5,43 l
di H2
=5,43 l
di H2
 edutecnica
edutecnica