Stechiometria
La stechiometria è il settore della chimica che si occupa di quantificare le relazioni quantitative tra reagenti e prodotti in una reazione chimica. Essa si basa sul principio di conservazione della massa e utilizza le proporzioni molari per calcolare le quantità di sostanze coinvolte in una reazione chimica.
La stechiometria è fondamentale per determinare le quantità esatte di reagenti necessari per una reazione, nonché per calcolare i rendimenti teorici e percentuali di una reazione.
Un'equazione chimica bilanciata, contiene tutte le informazioni sulle particelle
e sulle moli coinvolte nella reazione.
I coefficienti dinanzi alle formule dei composti (coefficienti stechiometrici)
indicano la proporzione delle moli dei reagenti e dei prodotti.
Attenzione! Nell'equazione bilanciata non ci sono informazioni dirette sulle
masse impiegate nella reazione:
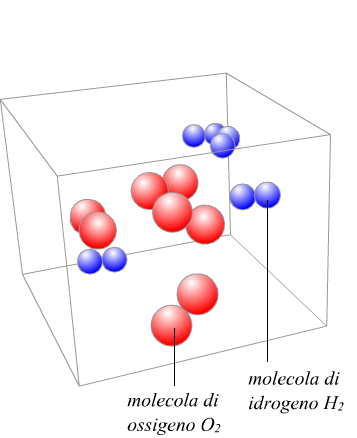
![]()
possiamo, solo dire che 2 moli di idrogeno reagiscono con 1 mole di ossigeno, ma non possiamo certo dire che 2 grammi di idrogeno si combinano con 1 grammo di ossigeno. La massa molare, costituisce il tramite tra il numero di moli e la massa corrispondente, secondo la relazione
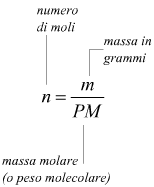
E' la massa molare (PM) che fa da tramite tra
il numero di moli (n) e la massa impiegata (m).
Se supponiamo di avere 1 mole di ossigeno che facciamo reagire con l'idrogeno,
cosa accade? Tenendo conto che
PM(H2)=2g/mol
PM(O2)=32g/mol
PM(H2O)=18g/mol
in base alla relazione m=n·PM
1·32=32g di O2
2·1=4g di H2
2·18=36g di H2O
Si conclude che un'equazione chimica, fornisce tutte le informazioni necessarie per calcolare per calcolare le quantità delle sostanze consumate o prodotte in una reazione.
Lo studio delle relazioni quantitative tra le moli dei reagenti e dei prodotti in una reazione prende il nome di stechiometria.
Ad esempio, nell'equazione bilanciata tra calcio e ossigeno si forma la calce viva
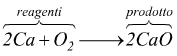
il rapporto quantitativo tra le moli delle sostanze è il seguente:
2 moli di calcio + 1 mole di ossigeno ⟶ 2 moli di ossido di calcio.
Ci possiamo chiedere quanti grammi di ossido di calcio si possono ottenere
da 15g di calcio metallico.
Sapendo che PM(Ca)=40 g/mol mentre PM(O2)=32 g/mol e PM(CaO)=56
g/mol
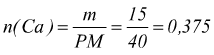 moli
di Ca
moli
di Ca
per ogni mole di O2 impiegato nella reazione ce ne vogliono 2 di Ca, quindi il numero di moli di ossigeno coinvolte nella reazione è
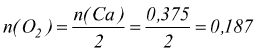 moli
di O2
moli
di O2
poi dall'equazione si vede che il numero di moli di calce viva prodotta
è pari a quello di calcio impiegato come reagente, dunque, saranno prodotte
0,375 moli di CaO.
![]() di CaO prodotta.
di CaO prodotta.
Reagente e limitante
Anche se facciamo combinare delle sostanze in quantità a nostro piacere, esse reagiscono sempre secondo il rapporto dato dall'equazione chimica. In queste circostanze, uno dei reagenti si consuma completamente e per questo viene chiamato reagente limitante, perché limita e determina la quantità di prodotto formato. L'altro reagente risulta in eccesso, e di conseguenza, rimane, in parte, non combinato.
I passaggi per individuare il reagente limitante, in modo sistematico, possono essere schematizzati nel modo seguente:
A Scrivere l'equazione chimica bilanciata.
B Convertire la massa in grammi di ciascun reagente
nelle moli corrispondenti.
C Calcolare per ciascun reagente il rapporto
tra le moli e il proprio coefficiente stechiometrico :
il reagente che presenta il più basso rapporto
moli/coefficiente è il reagente limitante.
Ad esempio, consideriamo il seguente quesito: si vogliono combinare 10g di Al e 10 g di F2O3 secondo l'equazione:
![]()
Tra le due sostanze che reagiscono: alluminio (Al) ed ematite (Fe2O3)
quale è il reagente limitante? Notiamo che:
PM(Al)=27 g/mol
PM(Fe2O3)=159,7 g/mol
PM(Fe)=55,84 g/mol
PM(Al2O3)=102 g/mol
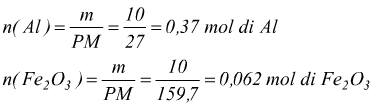
adesso possiamo individuare il reagente limitante
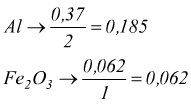
l'ematite Fe2O3 presenta il minor rapporto moli/coefficiente, essa è il reagente limitante. In base alla quantità di reagente limitante si possono poi trovare informazioni sulla quantità delle sostanze prodotte.
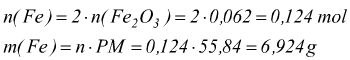
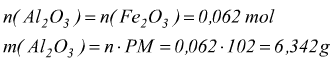
con ogni mole di limitante Fe2O3 reagiscono 2 moli di Al

quindi di 10 g di Al messi a disposizione solo 3,348 reagiscono. Risulterebbero eccedenti 6,652 g di Al.

Metodo degli equivalenti
Esiste un altro modo per determinare le relazioni ponderali tra prodotti e reagenti, evitando di passare attraverso l'equazione bilanciata, utilizzando la nozione di equivalente (o grammo - equivalente).
Gli equivalenti di un composto sono dati dal rapporto tra la massa in grammi del composto e dal suo peso equivalente.
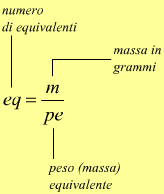
in questa pagina è riportato un promemoria sulla nozione di peso equivalente .
Ad esempio: calcolare quanti grammi di Ca(OH)2 si formano facendo
reagire 320g di di CaO con una sufficiente quantità di acqua senza ricorrere
all'equazione chimica.
Si devono individuare il numero di equivalenti dell'ossido di calcio CaO
messo a reagire con l'acqua H2O producono una incognita massa
di idrossido di calcio Ca(OH)2.
Ovviamente la reazione è
![]()
ma noi facciamo finta di niente.
Nel CaO il calcio ha numero di ossidazione +2

da 15 equivalenti di CaO si otterranno altrettanti equivalenti di Ca(OH)2. Ricordando che l'idrossido di calcio è una base che si dissocia secondo l'equilibrio
![]()
producendo 2 ioni idrossile OH- dunque
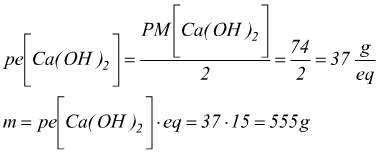
 edutecnica
edutecnica