Numeri quantici
La teoria di
Bohr sul modello dell'atomo di idrogeno ( 1913 ) ha dato un contributo
importante alla conoscenza del comportamento degli atomi, tuttavia,
la sua teoria non è in grado di dare una descrizione completa del comportamento
degli elettroni ed è stato evidente, fin dalla sua formulazione che
dovevano esistere dei fattori supplementari.
Nel 1926 Erwin Schrödinger elaborò un' equazione che descrive il comportamento
e l'energia di particelle sub-atomiche in generale; un'equazione analoga
alle leggi del moto di Newton della Fisica classica.
L' equazione di Schrödinger riesce a prevedere sia il comportamento
corpuscolare in termini della massa m della particella, sia il comportamento
ondulatorio, in termini di una funzione d'onda ψ , che descrive
la posizione del sistema nello spazio ( ad es. la posizione di un elettrone
in un atomo ).
La funzione d'onda,non ha un significato fisico diretto,ma il suo quadrato
è proporzionale alla probabilità di trovare la particella in una certa
regione nello spazio.
In pratica, il posto più probabile dove trovare una particella è quello
in cui il valore della funzione d'onda è massimo.
Una conseguenza di questo principio è che nel caso di un elettrone orbitante
in un atomo non si può parlare di traiettoria ma di regione dello spazio
in cui la probabilità di trovare l'elettrone è diversa da zero.
Descrizione quantomeccanica dell'atomo
Questa impostazione 'quantomeccanica' dell'atomo richiede che venga,
in qualche modo, superata la nozione di orbita per un elettrone, parlando
invece di orbitale che può essere pensato come la funzione d'onda di
un elettrone in un atomo.
Quando si dice che un elettrone si trova in un certo orbitale, si intende
che la distribuzione della densità elettronica viene descritta dalla
funzione d'onda associata a quel tale orbitale. Per la precisione, la
probabilità di localizzare l'elettrone nello spazio è dato dal valore
del quadrato della funzione d'onda in un dato punto.
Nella descrizione quantomeccanica dell'atomo, il moto degli elettroni
può essere rappresentato solo usando il concetto di probabilità. Gli
orbitali percorsi dagli elettroni non sono identificabili come traiettorie
ma come 'nuvole elettroniche' la cui densità è proporzionale alla probabilità
di trovare in quella regione l'elettrone.
Nella funzione d'onda ψ compaiono alcune costanti numeriche
chiamate numeri quantici
• Ogni orbitale è univocamente determinato da tre numeri quantici
n, l, m.
• Ogni orbitale può ospitare al
massimo 2 elettroni che differiscono di un quarto numero
quantico ms
( spin ).
• Lo stato di un elettrone in un atomo è definito dai suoi quattro
numeri quantici n, l, m, ms.
Ogni orbitale atomico è dotato di una serie univoca di questi numeri quantici.
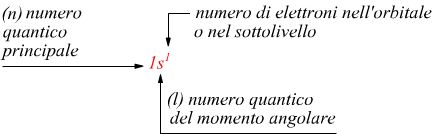
Numero quantico principale [ n ]
Individua le dimensioni dell'orbitale. Più grande è n, maggiore
è la distanza dal nucleo. n=1,2,3...7 esso corrisponde al numero
quantico del modello di Bohr; in quella teoria n determinava
automaticamente il contenuto energetico dell'orbita ma questa regola
non è più valida per un atomo 'multielettronico'.
Numero quantico del momento angolare [
l ]
Descrive la forma degli orbitali atomici. I valori di l sono
interi e dipendono dal valore del numero quantico principale n.
![]()
Ad ogni valore di l viene associata una delle lettere s, p, d ed f.
|
l |
0 |
1 |
2 |
3 |
|
|
s |
p |
d |
f |
Un insieme di orbitali aventi lo stesso valore di n viene chiamato
livello.
Uno o più orbitali aventi lo stesso valore di n ed l vengono chiamati
sottolivello.
Ad es. il livello n=2 è composto da due sottolivelli l=0
ed l=1 questi sottolivelli sono chiamati 2s e 2p dove 2 rappresenta
il valore di n ed s e p il valore di l.
Numero quantico magnetico [ m ]
Descrive l'orientamento degli orbitali nello spazio. All'interno di
un sottolivello il valore di m dipende dal valore di l.
Per un certo valore di l ci sono 2l+1 valori interi di
m.
![]()
Se l=1 ci sono tre possibili valori di m:-1,0,+1.
Per l=2 i valori possibili sono cinque m:-2,-1,0,+1,+2.
Per l=3 i valori possibili sono sette m:-3,-2,-1,0,+1,+2.+3
e così via.
Il numero dei valori di m indica il numero di orbitali in un sottolivello
con un particolare valore di l, ciascun valore di m si riferisce
ad un differente orbitale.
Il numero totale dei valori di m coincide col numero totale di orbitali
possibili per un dato valore di n.
Qundi assegnato [ n ] vi sono n2 orbitali e per un
massimo 2n2 elettroni.
Da queste osservazioni si deduce:
• un orbitale s contiene al massimo 2
elettroni
• un orbitale p contiene al massimo 6 elettroni
• un orbitale d contiene al massimo 10 elettroni
• un orbitale f contiene al massimo 14 elettroni
Configurazione elettronica
L'atomo di idrogeno è un sistema relativamente semplice, dato che contiene
un solo elettrone.
L'elettrone può risiedere nell'orbitale 1s ( stato fondamentale ) oppure
in qualsiasi altro orbitale a maggiore energia ( stato eccitato ) .
Con sistemi multielettronici si ha ( almeno ) l'esigenza di conoscere
la configurazione elettronica dello stato fondamentale.
Bisogna, inoltre, precisare che le energie relative degli orbitali atomici
di un sistema multielettronico sono differenti rispetto a quelle di
un sistema monoelettronico come l'atomo di idrogeno.
Energie degli orbitali atomici
Le energie degli orbitali dell'atomo di idrogeno dipendono soltanto dal numero quantico principale [ n ] l'energia aumenta all'aumentare di n per questo motivo gli orbitali che appartengono allo stesso livello possiedono la stessa energia indipendentemente dal sottolivello cui appartengono.
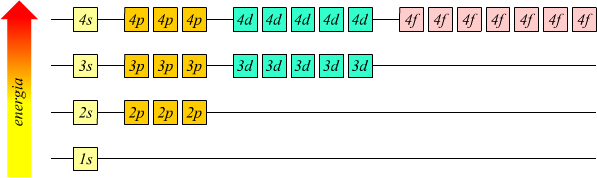
Se paragoniamo fra loro gli spettri
di emissione dell'atomo di idrogeno con quello dell'atomo di elio
si nota come questo ultimo abbia più righe di quello dell'idrogeno,
dato che in un atomo di elio esistono più transizioni possibili che
corrispondono ad emissioni nel campo del visibile, rispetto ad un atomo
di idrogeno. Questo è dovuto alla divisione
dei livelli energetici attribuibili all'interazione elettrostatica tra
gli elettroni.
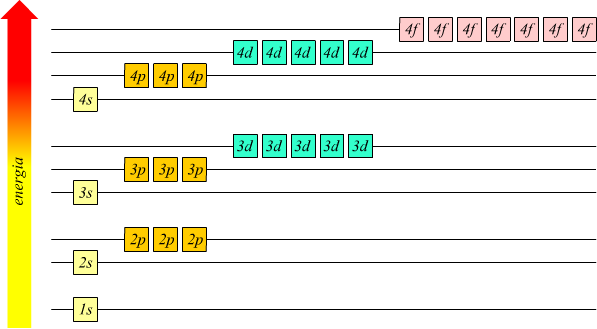
Al contrario dell'atomo di idrogeno, in cui l'energia di un orbitale
dipende solamente dal valore di [ n ] l'energia di un sistema
multielettronico dipende tanto dal valore di [ n ] che da quelli
di [ l ].
Dallo schema risulta l'ordine generale delle energie degli orbitali
in atomi multielettronici.
Al contrario dell'atomo di idrogeno, in cui l'energia di un orbitale
dipende solamente dal valore di [ n ], l'energia di un sistema
multielettronico dipende tanto dal valore di [ n ] che da quelli
di [ l ].
Principio di esclusione di Pauli
Il principio di esclusione di Pauli afferma che in un atomo due elettroni non possono avere tutti i numeri quantici uguali .
Se due elettroni di un atomo possiedono gli stessi valori di [ n ] , [ l ] ed [ m ] che significa che occupano lo stesso orbitale, allora devono avere valori diversi di [ ms ] cioè uno deve avere ms=+1/2 e l'altro ms=-1/2.
Un orbitale atomico può sempre essere al
massimo occupato da due elettroni che hanno spin opposti.
Possiamo indicare la disposizione degli elettroni negli orbitali atomici
con la seguente numenclatura:
Possiamo anche rappresentare la disposizione degli elettroni di un atomo impiegando i diagrammi orbitali in cui ciascun orbitale viene rappresentato con una casella con un simbolo inscritto. I diagrammi per gli atomi di idrogeno ed elio nella loro configurazione fondamentale sono:
![]()
La freccia verso l'alto indica uno dei due possibili spin ( uno dei due valori possibili di ms ) dell'elettrone. Nel caso dell'elio il simbolo indica che ci sono due elettroni 1s con spin opposti.
Principio dell'Aufbau
E' possibile scrivere la configurazione elettronica di tutti gli elementi
sulla base della sequenza delle energie per gli orbitali e del principio
di esclusione di Pauli.
Questo procedimento è basato sul principio dell'Aufbau che rende possibile
costruire la tavola periodica degli elementi determinando la loro configurazione
elettronica progressivamente.
Ogni passo richiede l'aggiunta di un elettrone all' orbitale appropriato
Dopo l'elio, l'elemento successivo nella tavola periodica è il litio
che possiede tre elettroni.
A causa del principio di esclusione di Pauli un orbitale non può ospitare
più di un elettrone, quindi il terzo elettrone non può stare nell'orbitale
1s: dovrà occupare l'orbitale successivo con energia più bassa possibile.
Quindi la configurazione elettronica del litio è 1s22s1.
![]()
In modo analogo si ottiene la configurazione elettronica del berillio che ha quattro elettroni come 1s22s2.
![]()
Adesso entrambi gli orbitali 1s e 2s sono completamente occupati, mentre l'elemento successivo, il boro, possiede cinque elettroni e il suo elettrone supplementare deve posizionarsi nel sottolivello 2p dato che tutti e tre i sottolivelli 2p hanno la stessa energia ( sono degeneri ) esso potrà occupare indifferentemente uno qualsiasi di loro.
![]()
Regola di Hund
La regola di Hund o principio della massima molteplicità, afferma che
se due elettroni occupano orbitali degeneri , cioè con uguali valori
di [ n ] ed [ l ] essi si distribuiscono con spin paralleli sul numero
massimo possibile di questi.
La disposizione più stabile per elettroni in orbitali aventi la stessa
energia ( degeneri ) è quella in cui è massimo il numero di elettroni
con lo stesso spin. Due elettroni con lo stesso spin non possono occupare
lo stesso orbitale; si può rendere massimo il numero di elettroni con
lo stesso spin solo immettendo elettroni in orbitali separati.
Ad esempio per il carbonio la configurazione elettronica è 1s22s22p2.
![]()
In modo analogo per l'azoto si avrebbe 1s22s22p3.
![]()
Quando tutti gli orbitali 2p sono singolarmente occupati gli elettroni aggiuntivi si dovranno accoppiare con quelli già presenti negli orbitali, Quindi ad es. per ossigeno, fluoro e neon si avrebbe:

Sulla base degli esempi visti si possono ricavare le seguenti
regole generali per ricavare le configurazioni
elettroniche dei vari atomi:
1) Gli elettroni devono occupare gli orbitali disponibili
a più bassa energia
2) Ogni orbitale può ospitare al massimo 2 elettroni
3) Se è disponibile un orbitale vuoto, gli elettroni non si accoppiano
nello stesso orbitale ma si distribuiscono
in modo da occupare tutti
gli orbitali degeneri disponibili.
4) Gli orbitali si riempiranno rispettando lo schema
dei livelli energetici.
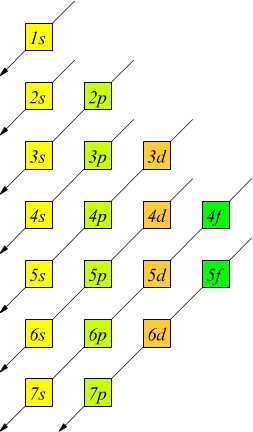
Il disegno a lato rappresenta un ulteriore schema per ricordarsi la progressione dei livelli energetici, tenendo conto del numero massimo di elettroni che possono essere collocati su ciascun orbitale..
Ricordiamo, inoltre, le regole convenzionali per indicare la configurazione
elettronica di un elemento chimico.
Dato un elemento chimico ad es. bromo [ Br ] con numero atomico z=35
; si cerca il gas nobile che precede l'elemento,
in questo caso l'argon [ Ar ].
Si aggiungono poi gli elettroni esterni della configurazione di valenza.
[Br]=[Ar] 4s2 3d10 4p5
 edutecnica
edutecnica