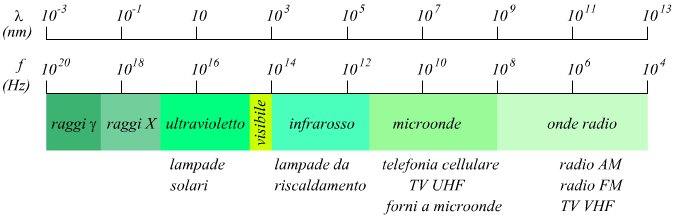
Spettro elettromagnetico
Quando si parla della luce si intende generalmente la luce visibile,
che è la radiazione che può essere percepita dalla nostra vista, tuttavia
essa è solo una piccola porzione di un 'continuo' di radiazioni di cui
è composto lo spettro elettromagnetico.
Oltre alla luce visibile nello spettro elettromagnetico sono comprese
altre radiazioni come le onde radio, le microonde, le radiazioni infrarosse
ed ultraviolette, i raggi X ed i raggi gamma come indicato nel seguente
disegno.
Nel 1873 James Clerk Maxwell propose che anche la luce visibile fosse
fosse costituita da onde elettromagnetiche; in accordo alla sua teoria,
un'onda elettromagnetica possiede una componente di campo elettrico
e una di campo magnetico.
Queste due componenti oscillano su due assi ortogonali e si propagano
lungo una direzione ortogonale al piano definito dai due assi precedenti.
Le due componenti elettrica e magnetica hanno la stessa lunghezza d'onda
λ ,frequenza f e di conseguenza velocità v
( c=3×108 m/s ):
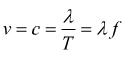
Esperimento della doppia fenditura
Durante la fine del XIX secolo, la natura ondulatoria della luce fu
accertata dall'esperimento della doppia fenditura.
Quando una sorgente di luce attraversa una fessura sottile ( fenditura
) si crea una linea luminosa sul cammino della luce attraverso la fenditura
stessa.
Se la stessa sorgente luminosa attraversa due fenditure molto vicine,
il risultato non sono due linee luminose, ognuna allineata con la rispettiva
fenditura, ma una serie di linee chiare e scure chiamate nel complesso
figure di interferenza.

Le sorgenti luminose, si ricombinano dopo il passaggio attraverso le
fenditure e lo fanno in maniera costruttiva quando le due onde sono
in fase ( dando luogo a linee chiare ) e in maniera distruttiva quando
le onde sono fuori fase (dando luogo a linee scure ).
L'interferenza costruttiva e distruttiva è una proprietà delle onde.
Quindi, fino ad un certo punto si è pensato che la teoria ondulatoria
fosse sufficiente a descrivere il comportamento della luce e delle onde
elettromagnetiche in generale.
La teoria ondulatoria della luce non riesce a
spiegare tre fenomeni fisici:
lo spettro di emissione del corpo nero, gli spettri a righe e l'effetto
fotoelettrico.
Quantizzazione dell'energia
Quando un solido viene scaldato, emette una radiazione elettromagnetica
in un certo campo di lunghezze d'onda; questo fenomeno è noto come radiazione
del corpo nero.
Esempi di radiazione del corpo nero sono il bagliore rosso della resistenza
di un forno elettrico oppure metallo riscaldato.
Effettuando le misure risulta che la quantità di energia rilasciata
da un corpo nero ad una certa temperatura dipende dalla lunghezza d'onda
della radiazione emessa.
Alla fine del XIX secolo furono effettuati vari tentativi per inquadrare
il fenomeno nell'ambito della teoria ondulatoria ma tutti senza successo.
Queste difficoltà erano dovute al fatto che si assumeva che l'energia
radiante fosse assorbita o rilasciata con continuità.
Fu Max Planck nel 1900 a suggerire l'idea che l'energia radiante potesse
essere emessa o assorbita solo in quantità discrete.
In quella circostanza, venne coniato il termine quanto
per indicare la più piccola quantità che può essere irradiata o assorbita
sotto forma di radiazione elettromagnetica.
L'energia E di un singolo quanto vale:
![]()
h=6,63×10-34 [J·s]=costante
di Planck.
mentre f=frequenza [Hz]
Secondo la teoria quantistica l'energia
viene sempre emessa in multipli interi di hf.
Chiaramente, in quel periodo degli inizi del XX secolo, nessuno ancora
riusciva a spiegare perchè le energie dovessero essere fissate e quantizzate
in quel modo.
Effetto fotoelettrico
Nel 1905 Albert Einstein presentò una sua teoria per spiegare l'effetto
fotoelettrico; un fenomeno che consiste nell'espulsione di elettroni
dalla superficie di un metallo esposto alla radiazione dotata di una
determinata frequenza minima ( frequenza di soglia ).
Le misure rivelavano che era il numero di elettroni emessi e non la
loro energia ad essere proporzionali alla radiazione incidente. Al di
sotto della frequenza di soglia non veniva emesso alcun elettrone indipendentemente
dall'intensità della radiazione.
Cioè, ci si aspettava un comportamento lineare, con la quantità di elettroni
emessi direttamente proporzionale all'intensità luminosa, in vece il
comportamento era di tipo non lineare, oltretutto con la quantità di
elettroni emessi proporzionale alla frequenza e non all'intensità della
radiazione.
Nemmeno l'effetto fotoelettrico poteva essere spiegato dalla teoria
di Maxwell che afferma che l'energia della luce è proporzionale alla
sua intensità.
Nel suo lavoro, Einstein, fece l'assunzione che un fascio di luce fosse
in realtà un fascio di particelle a cui in seguito venne dato il nome
di fotoni. Einstein confermò la teoria quantistica
della radiazione, utilizzando l'ipotesi di Planck E=hf.
Se la frequenza dei fotoni è tale che il prodotto hf eguagli
esattamente l'energia che lega l'elettrone al metallo allora la luce
avrà energia sufficiente per strappare l'elettrone.
L'interpretazione corpuscolare della luce proposta da Einstein era incompatibile con la descrizione che ne faceva la teoria ondulatoria, ma col tempo ci si dovette rassegnare alla natura duale delle radiazioni elettromagnetiche: la radiazione elettromagnetica si comporta da onda o da particella a secondo del tipo di esperimento (osservazione) che si compie.
Spettri atomici a righe
Qualsiasi corpo caldo è dotato di uno spettro di emissione delle onde
elettromagnetiche, spesso, come nel caso di un metallo riscaldato al
calor bianco questo spettro arriva fino a manifestarsi nelle lunghezze
d'onda del visibile.
La luce solare mostra una gamma continua di lunghezze d'onda, dal rosso
al violetto.
A differenza del sole, gli spettri di emissione degli atomi in fase
gassosa, non mostrano questa continuità nel loro spettro di emissione
ma producono delle righe brillanti in regioni ben distinte nella gamma
del visibile.

A differenza del sole, gli spettri di emissione degli atomi in
fase gassosa, non mostrano questa continuità nel loro spettro
di emissione ma producono delle righe brillanti in regioni ben
distinte nella gamma del visibile.
Questi spettri a righe corrispondono all'emissione di luce solo
a specifiche lunghezze d'onda .
Ogni elemento possiede uno spettro di emissione caratteristico,
tanto che le righe presenti nel suo spettro atomico possono essere
impiegate nell'analisi chimica per l'identificazione di elementi
incogniti.
Nel 1885 fu elaborata una semplice equazione che descriveva le lunghezze d'onda delle quattro righe visibili dello spettro di emissione dell'idrogeno:
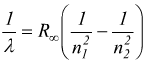
λ=lunghezza d'onda di una riga dello spettro
R∞ =1,0973×107 [1/m]=
costante di Rydberg
n1 ed n2 sono numeri positivi con
n2 > n1.
Questo fenomeno, non era inquadrabile attraverso la teoria ondulatoria,
e le sue ragioni rimasero misteriose ancora per parecchi anni successivi.
Modello atomico di Bohr
Nel 1913, Niels Bohr propose una spiegazione teorica dello spettro di emissione a righe dell'atomo di idrogeno. In quell'epoca, già si ipotizzava, per l'atomo, un modello di struttura simile al modello planetario che vede i vari pianeti girare attorno al Sole; si era a conoscenza che che l'atomo era costituito da un nucleo di protoni e neutroni, circondato da elettroni in movimento.
Data l'analogia, si pensava di poter applicare le leggi della meccanica classica; in questo caso un elettrone in moto su di un'orbita attorno all'atomo di idrogeno avrebbe dovuto subire una accelerazione verso il nucleo irradiando energia sotto forma di onde elettromagnetiche. Teoricamente si prevedeva che l'elettrone sarebbe caduto sul nucleo .
Per spiegare perché questo non avviene, Bohr postulò che l'elettrone potesse occupare solo alcune orbite consentite, ognuna avente una energia specifica. Anche egli fece ricorso alla teoria di Planck, ipotizzando che le energie degli elettroni fossero quantizzate. Un elettrone in qualsiasi delle orbite permesse non avrebbe irradiato energia e di conseguenza non sarebbe caduto sul nucleo.
Bohr attribuì l'emissione di radiazioni da un atomo di idrogeno all'elettrone ( l'unico elettrone ) che passando da un'orbita ad alta energia ad una inferiore, perde un quanto di energia (fotone) sotto forma di luce . Nella sua teoria, le energie che un elettrone dell'atomo di idrogeno può possedere sono date dalla formula:
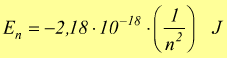 [#] con
n=1,2,3..
[#] con
n=1,2,3..
Il segno negativo dell'equazione è una convenzione arbitraria, che indica che l'energia dell'elettrone orbitante attorno all'atomo ( nel suo stato fondamentale ) è minore dell'energia dell'elettrone libero, cioè di un elettrone che si trovi a distanza infinita dal nucleo; matematicamente questo corrisponde a imporre n=∞
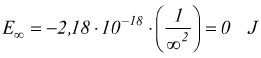
Man mano che l'elettrone si avvicina al nucleo ( al diminuire di n ) En diventa più grande in valore assoluto. Il valore più negativo si raggiunge quando n=1 che corrisponde allo stato energetico più stabile.
Dunque, viene definito stato fondamentale
per un atomo, lo stato a più bassa energia. La stabilità di un elettrone
diminuisce all'aumentare di n.
Ogni stato energetico con n>1 viene definito stato eccitato.
Tutti gli stati eccitati si trovano ad energia maggiore rispetto allo
stato fondamentale.
Il raggio di ogni singola orbita circolare nel modello di Bohr è funzione
di n2.
Conseguentemente mentre n aumenta da 1 a 2 a 3 il raggio dell'orbita
aumenta più rapidamente.
Più lontano è lo stato eccitato, più distante è l'elettrone dal nucleo.
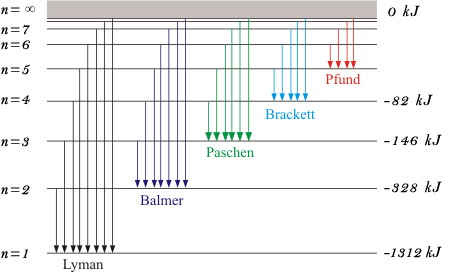
La teoria di Bohr ha permesso di spiegare lo spettro a righe dell'atomo di idrogeno.
L'energia radiante assorbita dall'atomo causa il passaggio dell'elettrone dallo stato fondamentale ( n=1) ad uno stato eccitato n> 1. Per contro, l'energia radiante ( sotto forma di fotone ) viene emessa quando l'elettrone passa da uno stato eccitato ad energia più alta ad uno stato eccitato ad energia inferiore allo stato fondamentale.
Il moto quantizzato dell'elettrone da uno stato energetico all'altro è analogo al moto di una pallina da tennis che rimbalza su una fila di scalini.
La pallina può trovarsi su qualsiasi gradino, ma mai in una posizione intermedia tra un gradino e l'altro.
Lo spostamento da un gradino inferiore ad un gradino superiore è un processo che richiede energia, mentre quello da un gradino superiore ad un gradino inferiore rilascia energia.
La quantità di energia coinvolta in ogni passaggio è determinata dalla distanza tra il gradino iniziale e quello finale. Analogalmente, l'energia richiesta per muovere un elettrone nell'atomo di Bohr dipende dalla differenza di livelli energetici tra gli stati iniziale e finale.
Se vogliamo applicare l'equazione [#] all'atomo di idrogeno , supponiamo
che inizialmente l'elettrone si trovi in uno stato eccitato ni
(iniziale) per passare ad uno stato energetico inferiore nf
(finale).
La differenza di energia sarà:
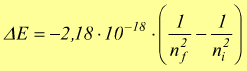
Questa transizione dà luogo all'emissione di un fotone di frequenza f.
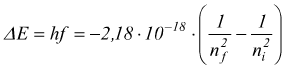
Poi calcoliamo la lunghezza d'onda di una riga di emissione
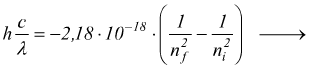
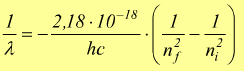
consideriamo solo il modulo perchè, ovviamente, non esistono lunghezze d'onda negative.
Proprietà ondulatorie della materia
La teoria di Bohr non chiariva come mai un elettrone era costretto ad orbitare attorno al nucleo solo a determinate distanze; questo fatto era inspiegabile. Solo nel 1924 Luis De Broglie ebbe l'intuizione.
L'ipotesi di De Broglie era che se l'energia ( la luce ) può comportarsi in certe circostanze come un fascio di particelle (fotoni ) probabilmente anche le particelle come gli elettroni in certe circostanze possono comportarsi come onde.
Nel suo ragionamento, De Broglie, pensò a quei fenomeni macroscopici che mostrano un comportamento quantizzato. Il caso tipico, sono le corde di una chitarra che possono vibrare solo a determinate frequenze discrete. Le onde generate dalle corde di una chitarra sono onde stazionarie perché non viaggiano lungo la corda ; alcuni punti della corda non si muovono affatto (nodi) e l'ampiezza dell'onda in quei punti è zero.
L'ipotesi De Broglie fu che se un elettrone nell'atomo di idrogeno si comporta come un'onda stazionaria, la lunghezza d'onda deve essere in relazione alla circonferenza dell'orbita, cioè la circonferenza dell'orbita deve essere un multiplo intero della lunghezza d'onda, altrimenti l'onda si autocancellerebbe per interferenza distruttiva.
La relazione tra la circonferenza di un'orbita di un'orbita 2πR e la lunghezza d'onda λ dell'elettrone è data da:
R=raggio dell'orbita
λ=lunghezza d'onda dell'elettrone
n=1,2,3..
La teoria di De Broglie condusse alla conclusione che le onde possono comportarsi come particelle e le particelle possono comportarsi come onde e per le proprietà ondulatorie delle particelle fu derivata la seguente legge:
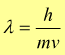
λ=lunghezza d'onda della particella
h=costante di Planck
m=massa della particella
Una lunghezza d'onda calcolata attraverso l'equazione precedente prende il nome di lunghezza d'onda di De Broglie.
Palesemente, per oggetti macroscopici, la lunghezza d'onda di De Broglie assume valori infinitesimali, per questo motivo la dualità onda-particella è riscontrabile solo per particelle subatomiche, perché queste hanno una massa molto piccola.
 edutecnica
edutecnica