Reazioni chimiche
La chimica studia la materia e le sue trasformazioni.
Nelle trasformazioni chimiche, usualmente chiamate reazioni
chimiche, le sostanze messe a reagire, dette reagenti,
si trasformano in altre sostanze, denominate prodotti
di reazione.
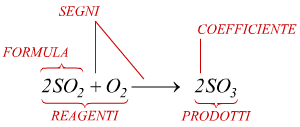
La reazione chimica è rappresentata con un'equazione chimica.
Al primo membro troviamo le formule
dei reagenti, mentre a secondo membro le formule dei prodotti di reazione.
L'equazione, per mezzo di segni, formule
e di coefficienti riesce a rappresentare
qualitativamente e quantitativamente lo stato iniziale e finale del
sistema in evoluzione.
La freccia in particolare, indica
il senso verso il quale evolve il sistema, determinando i due membri
dell' equazione, lasciando a sinistra i reagenti e mirando verso destra
, ai prodotti della reazione.
Per descrivere quantitativamente la reazione è necessario usare un numero
detto coefficiente stechiometrico
come prefisso a ciascuna formula.
Il coefficiente stechiometrico, specifica il numero di molecole di ciascuna
sostanza ( descritta dalla formula ) che partecipa alla reazione.
In chimica, si riportano in genere anche gli stati fisici dei reagenti
e dei prodotti che seguono la formula di ogni composto della reazione.
I gas, i liquidi, e i solidi sono contrassegnati con le scritte (g)
(l) (s) rispettivamente.
Le specie chimiche sciolte in acqua sono contrassegnate dalla sigla
(aq).
Bilanciamento di reazioni chimiche
Quando bilanciamo un'equazione chimica, possiamo cambiare solo i coefficienti, non i pedici posti in basso alle formule.
Bisogna, prima di tutto, rispettare il principio di conservazione della massa: il numero totale di atomi di ciascun elemento chimico, non varia prima e dopo la reazione, anche se si trova diversamente combinato nei prodotti rispetto ai reagenti.
La determinazione dei coefficienti stechiometrici costituisce il bilanciamento della reazione.
Bilanciare una reazione, vuol dire calcolare i coefficienti per i quali è necessario moltiplicare le formule delle specie chimiche che partecipano alla reazione, affinché ogni elemento compaia al primo e al secondo membro della reazione con lo stesso numero di atomi.
Ad esempio:
![]()
non rispetta la legge di conservazione della massa, perchè a sinistra
ci sono in totale due atomi di ossigeno, mentre a destra ne ho uno solo.
In questo caso poniamo a 2 il coefficiente dell'H2O a destra
e dell'H2 a sinistra ottenendo:
![]()
Ora abbiamo 4 (2×2) atomi di idrogeno e 2 di ossigeno sia a sinistra che a destra e l'equazione è bilanciata.
Bilanciare una reazione chimica, richiede spesso un approccio a tentativi.
In linea di massima, occorre applicare i seguenti criteri:
1) Cambiare i coefficienti dei composti (ad es.H2O) prima
di cambiare i coefficienti degli elementi (ad es.O2).
2) Considerare gli ioni poliatomici che compaiono sui due lati dell'equazione
[ ad es. (CO3)2- ] come singole unità, piuttosto
che andare a bilanciare singolarmente gli atomi che li costituiscono.
3) Calcolare gli atomi e/o gli ioni poliatomici attentamente e controllare
i loro numeri ogni volta che si cambia un coefficiente.
Prendiamo ad esempio la combustione del butano, non bilanciata:
![]()
4-C-1
10-H-2
2-O-3
Il bilancio iniziale degli atomi è rappresentato schematicamente a sinistra.
Cerchiamo dapprima di equilibrare il carbonio
![]()
4-C-4
10-H-2
2-O-9
ovviamente questa operazione ha modificato anche il conteggio degli atomi di ossigeno. Ora cerchiamo di equilibrare l'idrogeno, mettendo un 5 come coefficiente per H2O.
![]()
4-C-4
10-H-10
2-O-13
Adesso la reazione è bilanciata per carbonio ed idrogeno. Ora si deve bilanciare l'ossigeno. Ci sono 13 atomi di ossigeno sul lato dei prodotti, quindi abbiamo bisogno di 13 ossigeni sul lato dei reagenti.
Dato che ciascuna molecola di ossigeno contiene 2 atomi, abbiamo bisogno di un coefficiente 13/2 davanti ad O2.
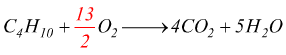
4-C-4
10-H-10
13-O-13
La reazione è già correttamente bilanciata. Tuttavia si preferisce rappresentare i coefficienti stechiometrici di una reazione, come numeri interi il più piccoli possibile.
Non resta che applicare il secondo principio di equivalenza (dell' algebra) moltiplicando ciascun coefficiente per due:
![]()
8-C-8
20-H-20
26-O-26
Osserviamo, a questo punto, come nel caso del bilanciamento della reazione di formazione dell'acqua si poteva anche scrivere
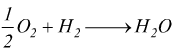
 edutecnica
edutecnica