Elettronegatività
Nel 1916 G.N.Lewis suggerì che ciò che tiene uniti gli atomi in una molecola
sia il legame covalente, in cui gli atomi mettono in comune (comproprietà)
i propri elettroni dell'orbita più esterna.
Infatti, per la regola dell'ottetto, quando un atomo forma un legame con
un altro atomo, cedendo, acquistando o condividendo elettroni, lo fa in
modo da soddisfare la regola dell'ottetto:
Ogni atomo, quando forma legami chimici con altri atomi assume una configurazione ad otto elettroni nel livello di valenza.
I gas nobili, che non si combinano con altri elementi, sono caratterizzati da un orbitale più esterno completo (8 elettroni elettroni di valenza). Gli elementi che non hanno questa prerogativa, tendono a combinarsi con gli altri mettendo in comproprietà i propri elettroni di valenza (sull'orbita più esterna) in modo da poterla interamente occupare di elettroni.
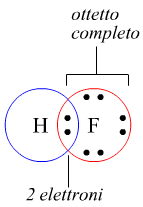
Un caso piuttosto esplicito è costituito dalla molecola del fluoro. Ogni atomo di fluoro è dotato sull'orbitale più esterno di 7 elettroni di valenza. A ciascun atomo di F manca un elettrone per completare l'orbitale più esterno. Questo obiettivo viene raggiunto quando i due atomi di fluoro, legandosi tra loro mettono in comune una coppia di elettroni provenienti uno da un atomo ed uno dall'altro atomo, raggiungendo in tal modo una configurazione elettronica ad otto elettroni di valenza sull'orbitale più esterno.

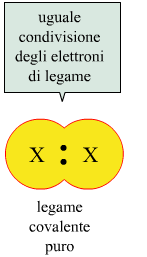
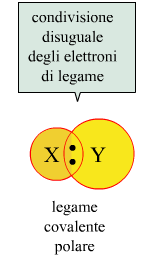
Questo tipo di legame è chiamato legame covalente puro e si verifica quando due atomi identici sono legati tra loro. Quando, invece, due atomi diversi formano un legame di questo tipo, il doppietto elettronico non sarà equamente condiviso, perchè un elemento presenterà una maggior forza di attrazione per gli elettroni, e l'altro elemento una minor forza. Si parla in tal caso di legame covalente polare.
Il legame covalente polare si presenta quando, ad esempio, l'idrogeno molecolare H2 e la molecola di fluoro F2 tendono a combinarsi secondo la reazione H2+F2 → 2HF. L'idrogeno ha un solo elettrone sull'orbita più esterna. Il fluoro, come detto, ha 7 elettroni sull'orbita più esterna. Mettendo in condivisione questi elettroni di valenza i due elementi possono completare il loro orbitale più esterno (completare l'ottetto nel caso del fluoro).
In un assetto di questo tipo, quando gli atomi combinati sono diversi tra loro, vi è sempre un atomo che attira di più gli elettroni dell'altro, cosa che non accade quando gli atomi combinati sono identici (come in H2 o in F2). Nel 1932 L.Pauling propose un parametro, chiamato elettronegatività (simbolo χ di cui si è già detto) per valutare il grado di polarità di un legame, cioè la ragione per cui un elemento presenta una maggior forza di attrazione per gli elettroni e l'altro una minor forza.
L'elettronegatività esprime la tendenza di un atomo che interagisce con un altro ad attrarre a sè gli elettroni di legame.
Nella molecola di HF la nuvola elettronica, è spostata verso il fluoro che avendo una elettronegatività maggiore (3,98) rispetto all'idrogeno (2,1) tende a spostare verso di sé gli elettroni acquisendo una parziale carica negativa. Al contrario dell'idrogeno che acquisisce una parziale carica positiva. In questo caso si parla di dipolo (2 poli) con l'idrogeno che fa da polo positivo e il fluoro che fa da polo negativo. Questa situzione viene indicata con la simbologia
![]()
δ+ = parziale carica positiva
δ-– = parziale carica negativa
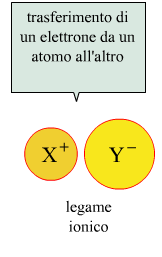
Quando lo spostamento della nuvola elettronica è molto pronunciato, gli elettroni di legame si trasferiscono del tutto su uno dei due atomi, ottenendo in tal modo un legame ionico.
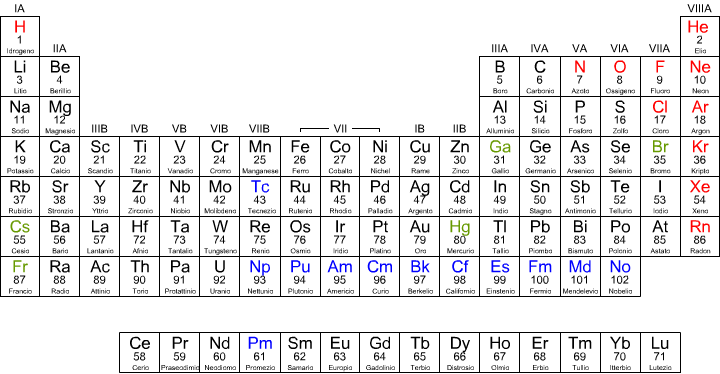
Nella tavola periodica, l'elettronegatività aumenta da sinistra verso destra, per cui assume valore più basso nei metalli alcalini (gruppo IA) quindi cresce per raggiungere il valore più alto con gli alogeni (gruppo VIIA). I valori per i gas nobili sono sconosciuti. L'elettronegatività diminuisce , con qualche eccezione , in un gruppo, dall'alto verso il basso. Pertanto nella tavola periodica, gli elementi più elettronegativi si trovano in alto a destra, quelli meno elettronegativi, in basso a sinistra.
 |
 |
|
|
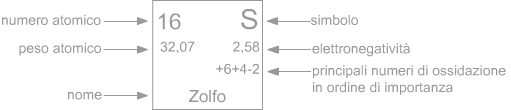
Numero di ossidazione
Per molto tempo è stato usato il termine valenza per rappresentare il numero di elettroni che un atomo guadagna, perde o mette in comune quando si lega con altri atomi. Nella moderna nomenclatura chimica al poso della valenza si preferisce utilizzare il termine : numero di ossidazione.
Il numero di ossidazionedi un atomo è la carica apparente (positiva o negativa) che esso mostra in un composto in confronto ad altri atomi a cui è legato.
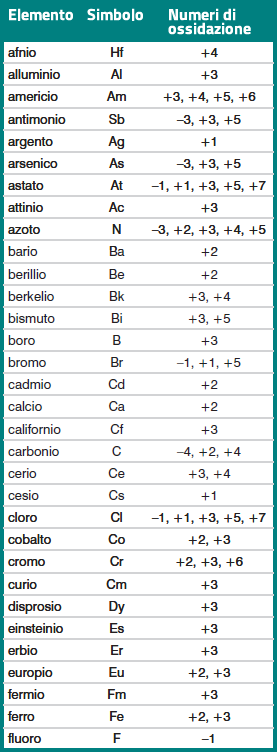
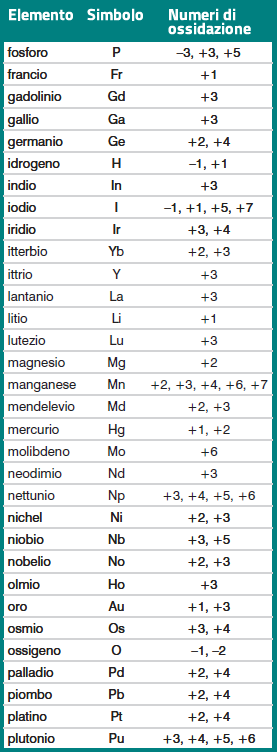
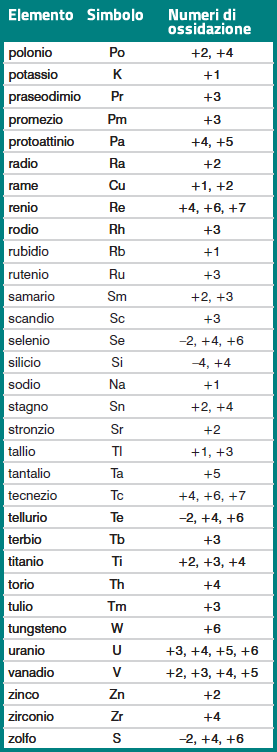
Come si vede dagli esempi riportati nella tabella, il numero di ossidazione
di un elemento in un composto è sempre preceduto dal segno + o dal segno
– .
Il segno – spetta all'elemento più elettronegativo,
poichè ad esso vengono formalmente assegnati gli elettroni di legame.
Il segno + spetta sempre a quello meno elettronegativo.
Le regole che convenzionalmente sono seguite per assegnare il numero di
ossidazione ad un elemento in un composto chimico sono le seguenti :
● Il numero di ossidazione degli elementi
allo stato elementare come Na, Al, Fe è zero.
● L'idrogeno possiede
numero di ossidazione +1, ad eccezione degli idruri dei metalli (LiH,
CuH,..n.b : idrogeno a destra nella formula) dove è -1 perchè in tal caso
l'idrogeno si combina con un elemento più elettronegativo.
● L'ossigeno possiede
numero di ossidazione -2 in tutti i suoi composti con l'eccezione
dei perossidi (tipo H2O2 , Na2O2)
in cui il numero di ossidazione è -1 e dei superossidi (tipo KO2)
in cui il numero di ossidazione è -1/2; oppure col fluoro in F2O,
in cui è + 2, perché il fluoro è più elettronegativo.
● Il numero di ossidazione degli elementi
del gruppo I allo stato combinato è sempre +1.
● Il numero di ossidazione degli elementi
del gruppo II allo stato combinato è sempre +2.
● Il numero di ossidazione allo stato combinato
è sempre –1 per F, +3 per Al e +2 per Zn.
● Il numero di ossidazione di un alogeno
(gruppo VIIA) è -1, se l'atomo a cui è legato ha elettronegatività minore.
● Nelle molecole
neutre la somma algebrica dei numeri di ossidazione dei singoli atomi è
zero.
Ad esempio nella molecola di acido nitrico HNO3 il numero di ossidazione dell'azoto (N) può essere calcolato assegnando numero di ossidazione +1 all'idrogeno (H) è numero di ossidazione -2 all'ossigeno (O).
![]()
se la somma algebrica dei numeri di ossidazione deve essere uguale a zero:
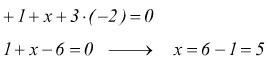
Il numero di ossidazione dell'azoto è +5.
● Ioni monoatomici hanno numero di ossidazione
uguale alla carica dello ione.
Ad esempio, il numero di ossidazione di Ca2+ è +2; il numero
di ossidazione di Al3+ è +3, etc.
● In uno ione poliatomico la somma algebrica
dei numeri di ossidazione di tutti gli atomi è uguale alla carica dello
ione.
In MnO4- il numero di ossidazione del manganese Mn
può essere calcolato nel modo seguente:
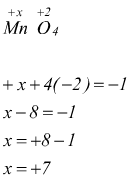
Se il legame è ionico, ad esempio fra lo ione Na+ e lo ione Cl-, nella formazione di NaCl, il sodio ha numero di ossidazione +1 mentre il cloro -1.
Se il legame è di tipo covalente, i doppietti elettronici si considerano assegnati all'atomo più elettronegativo.
La molecola di NH3 ha la seguente struttura : 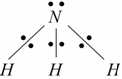
e gli elettroni di legame sono rappresentati da segni diversi, in quanto nella formazione di ciascuno dei legami N-H un elettrone è formalmente donato dall'azoto e uno dall'idrogeno. N è più elettronegativo di H e quindi i due elettroni di ciascun legame vengono attribuiti all'atomo di azoto secondo le regole dette sopra.
In ragione di questa attribuzione N possiede 3 elettroni in più (uno per ogni legame N-H) rispetto ad un atomo di azoto non legato ed è quindi come se possedesse una carica -3, in quanto ciascun elettrone in eccesso, genera una carica -1: si dice che nell'ammoniaca N possiede numero di ossidazione -3. Ad ogni atomo di H in NH3 viene convenzionalmente attribuito un elettrone in meno rispetto ad un atomo di idrogeno non combinato.
E' come se l'idrogeno possedesse carica +1; si dice che nell'ammoniaca H ha numero di ossidazione +1. Come si vede la somma algebrica dei numeri di ossidazione degli atomi NH3 (specie non ionica) è zero.
In CO2 i numeri di ossidazione, scritti al di sopra degli atomi
sono +4 per C e -2 per O: ![]() :
:
![]()
e ricordando che l'ossigeno è più elettronegativo del carbonio avremo
che i 4 elettroni di ciascun doppio legame sono attribuiti convenzionalmente
all'ossigeno . Perciò nel biossido di carbonio O ha un numero di ossidazione
-2, in quanto ciascun O possiede due elettroni in più dell'ossigeno non
combinato.
La somma algebrica dei numeri di ossidazione dei tre atomi di CO2
deve essere zero. e quindi ciascun atomo di O ha numero di ossidazione
-2.
Rappresentando con x[C] ed x[O] i numeri di ossidazione di carbonio ed ossigeno risulta:
xC+2xO=0
xC+(-4)=0
xC=+4
D'altra parte, in seguito all'attribuzione degli elettroni di legame , C ha 4 elettroni in meno rispetto ad un atomo di carbonio non combinato e quindi è come se avesse carica +4, cioè ha numero di ossidazione +4.
In Cl2 ciascun atomo di cloro ha numero di ossidazione 0. Infatti gli atomi di cloro hanno, ovviamente, la stessa elettronegatività ed i due elettroni vengono equripartiti tra i due atomi.
Dato che nella formazione di di una molecola di cloro da due atomi isolati, ciascun atomo fornisce un elettrone per il legame, risulta che in seguito alla convenzionale equipartizione degli elettroni di legame, ciascun atomo di Cl2 possiede lo stesso numero di elettroni che ha quando è isolato, di conseguenza il numero di ossidazione è uguale a zero.
![]()
nello ione ![]() ha
la struttura rappresentabile nelle forme di risonanza:
ha
la struttura rappresentabile nelle forme di risonanza:
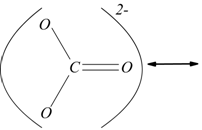
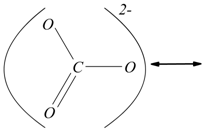
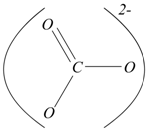
Il carbonio ha numero di ossidazione +4, in quanto tutti gli elettroni
dei quattro legami sono attribuiti agli atomi di ossigeno. La somma algebrica
dei numeri di ossidazione di tutti gli atomi presenti nello ione è uguale
alla carica dello ione e di conseguenza il numero di ossidazione di tutti
gli atomi presenti nello ione è uguale alla carica dello ione e di conseguenza
il numero di ossidazione dell'ossigeno in ![]() è
-2.
è
-2.
Infatti:
xC+3xO=-2
+4+3xO=-2
xO=-2
 edutecnica
edutecnica