Forze intermolecolari
Una sostanza è una forma di materia
che ha composizione e proprietà definite e costanti. Tutte le sostanze
in linea di principio possono esistere in forma
solida, liquida o aeriforme: questi sono i tre stati
fisici della materia.
In un solido le particelle sono tenute assieme in modo estremamente
ordinato, con pochissima libertà di movimento.
Un solido non si adatta ne alla forma ne al volume di un suo contenitore.
In un liquido, le particelle sono vicinissime, ma non sono ferme nelle
loro posizioni, sono libere di muoversi reciprocamente, un liquido si
adatta alla forma di un suo contenitore ma non al suo volume.
In un gas le particelle sono separate da distanze relativamente grandi
se paragonate alle dimensioni delle particelle stesse, un gas si adatta
sia alla forma che al volume di un suo contenitore.
I tre stati della materia possono poi trasformarsi l'uno nell'altro
senza che venga ad alterarsi la composizione chimica della sostanza.
Questi processi vengono chiamati passaggi
di fase.
Una fase è una porzione omogenea di
un sistema separata dal resto del sistema da contorni ben definiti.
Ad esempio, quando un cubetto di ghiaccio galleggia nell'acqua, l'acqua
liquida costituisce appunto la fase liquida mentre il cubetto di ghiaccio
rappresenta la fase solida.
Sebbene le proprietà chimiche dell'acqua siano le stesse in entrambe
le fasi non lo sono le proprietà fisiche.
Al contrario dei gas le sostanze delle fasi condensate (liquidi e solidi)
presentano le loro particelle a stretto contatto le une con le altre
in modo molto coeso.
Le forze attrattive che uniscono le particelle delle fasi condensate
sono chiamate forze intermolecolari
ed proprio a secondo dell'entità di queste forze a determinare se una
sostanza si presenta nello stato solido liquido o aeriforme.
Un tipico esempio di forza intermolecolare è il legame ionico; in questo
caso vi è attrazione tra ioni di segno opposto (dotati di carica netta)
e la forza attrattiva instaurata, particolarmente intensa, è dettata
dalla legge di Coulomb.
Negli altri tipi di legame, gli atomi sono parzialmente carichi e sono
tenuti assieme da elettroni condivisi (non da cariche nette) . Le forze
instaurate sono sempre di tipo coulombiano ma sono più deboli rispetto
a quelle che ci sono nei legami ionici.
Interazioni tra ioni e dipoli
Se una molecola biatomica contiene elementi che hanno una significativa differenza di elettronegatività come ad es. HCl la densità elettronica sulla sua superficie non è equamente distribuita ma si viene a creare una parziale carica positiva sull'elemento più elettropositivo (H) e una parziale carica negativa su quello più elettronegativo (Cl) .
Si ha in questo modo la formazione di un dipolo elettrico caratterizzato
da una distribuzione non uniforme della carica elettrica evidenziata
in rosso da una prevalenza di carica positiva ed in blu da una prevalenza
di carica negativa, pertanto, una carica parziale positiva presente
su una molecola vene attratta da una carica parziale con la carica parziale
negativa presente su di un'altra molecola vicina.
Nel disegno seguente viene evidenziato l'orientazione delle molecole
delle fasi condensate
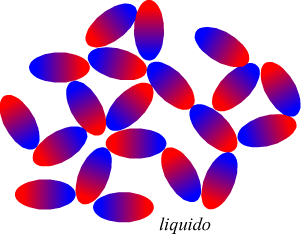
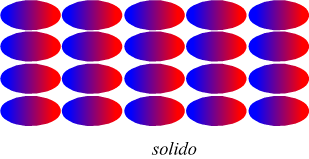
si può notare come la strutturazione sia più ordinata in un solido
che in un liquido.
 Sono
poi possibili anche interazioni tra ioni e molecole polari che possono
attuarsi in miscele tra specie ioniche e specie polari.
Sono
poi possibili anche interazioni tra ioni e molecole polari che possono
attuarsi in miscele tra specie ioniche e specie polari.
L'intensità delle forze che si sviluppano dipendono sia dalla carica
che dal raggio dello ione che dalle dimensioni e da momento dipolare
della molecola polare coinvolta.
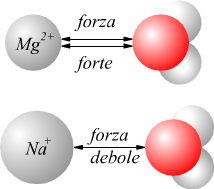
Nel disegno si vede come due ioni Na+ e Mg2+ possono
interagire diversamente con una molecola polare come l'acqua: in entrambi
i casi la carica positiva sullo ione viene attratta dalla carica parziale
negativa dell'ossigeno sulla molecola di acqua. L'attrazione è coulombiana
e quindi è tanto più forte quanto più è piccola è la distanza tra le
due specie.
Proprietà dei liquidi
Molte proprietà fisiche di un liquido dipendono dall'intensità delle forze intermolecolari che si sviluppano in esso; tra le più importanti proprietà dei liquidi vi sono la tensione superficiale, la viscosità e la tensione di vapore.
Tensione superficiale
In virtù delle forze intermolecolari, una molecola all'interno di un liquido viene attirata in tutte le direzioni dalle molecole che la circondano.
 All'interno del liquido la risultante delle forze cui è soggetta una
molecola è nullo mentre una molecola che si trova sopra la superficie
di un liquido viene attirata dalle molecole che si trovano sotto di
essa ed ai suoi lati, ne consegue che la superficie del liquido prende
l'aspetto di una superficie elastica tesa, occupata dal minor numero
possibile di molecole.
All'interno del liquido la risultante delle forze cui è soggetta una
molecola è nullo mentre una molecola che si trova sopra la superficie
di un liquido viene attirata dalle molecole che si trovano sotto di
essa ed ai suoi lati, ne consegue che la superficie del liquido prende
l'aspetto di una superficie elastica tesa, occupata dal minor numero
possibile di molecole.
Questa forza elastica che si instaura sulla superficie del liquido prende
il nome di tensione superficiale;
essa viene definita come la quantità di energia necessaria per incrementare
la superficie di un liquido di una unità di area (ad es. 1cm2)
.
Un liquido caratterizzato da elevate forze intermolecolari ha un'elevata
tensione superficiale.
Una esplicita manifestazione della tensione superficiale è l'azione
capillare : un fenomeno che comporta l'incurvamento della superficie
di un liquido contenuto in un tubo sottile.
Viscosità
La misura della resistenza che un liquido presenta a scorrere viene
chiamato viscosità [N·s/m2 ] .
Maggiore è la viscosità, più lentamente scorre un liquido.
Un liquido caratterizzato da elevate forze intermolecolari ha un'elevata
viscosità .
Generalmente la viscosità di un liquido diminuisce all'aumentare della
temperatura anche se altre informazioni su questa propietà fisica
sono già state annotate.
Tensione di vapore
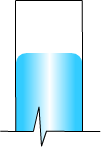
Ipotizziamo il seguente sistema, costituito da un recipiente parzialmente riempito di un liquido nel quale sia stato creato il vuoto e dotato di manometro a U. Appena il liquido inizia ad evaporare le molecole lasciano la fase liquida e passano alla fase gassosa andando ad occupare lo spazio al di sopra del liquido ed esercitando una pressione su quest'ultimo.
Le molecole nella fase gassosa possono ritornare in fase liquida se, urtando contro la superficie, sono trattenute dalle forze intermolecolari: questo fenomeno è chiamato condensazione.
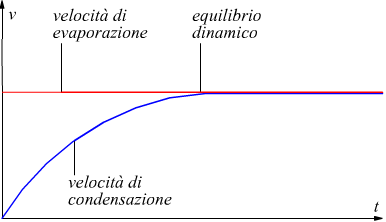 All'inizio,
l'evaporazione procede più velocemente della condensazione, gradualmente,però,
all'aumentare delle molecole in fase gassosa, cresce la velocità di
condensazione. Aumenta, quindi, la pressione esercitata dal vapore sul
liquido finché la velocità di condensazione non sarà uguale alla velocità
di evaporazione . Da questo punto in poi il processo diretto (evaporazione)
ed il suo inverso (condensazione) procedono alla stessa velocità, instaurando
quello che si chiama un equilibrio dinamico.
In altri termini, sebbene entrambi i processi siano attivi, il numero
di molecole in fase gassosa rimane costante. La condizione di equilibrio
viene registrata dal manometro ad U che, a regime, misura la pressione
parziale del liquido evaporato attraverso la misura h del tubo ad U
(infatti è p=ρgh con ρ=densità
del liquido manometrico).
All'inizio,
l'evaporazione procede più velocemente della condensazione, gradualmente,però,
all'aumentare delle molecole in fase gassosa, cresce la velocità di
condensazione. Aumenta, quindi, la pressione esercitata dal vapore sul
liquido finché la velocità di condensazione non sarà uguale alla velocità
di evaporazione . Da questo punto in poi il processo diretto (evaporazione)
ed il suo inverso (condensazione) procedono alla stessa velocità, instaurando
quello che si chiama un equilibrio dinamico.
In altri termini, sebbene entrambi i processi siano attivi, il numero
di molecole in fase gassosa rimane costante. La condizione di equilibrio
viene registrata dal manometro ad U che, a regime, misura la pressione
parziale del liquido evaporato attraverso la misura h del tubo ad U
(infatti è p=ρgh con ρ=densità
del liquido manometrico).
Si definisce tensione di vapore la pressione esercitata dalle molecole in fase gassosa in condizioni di equilibrio dinamico con la fase liquida.
La tensione di vapore è chiaramente dipendente dalla natura chimica della sostanza liquida e dalla temperatura, questo perché l'energia cinetica media delle molecole aumenta all'aumentare della temperatura.
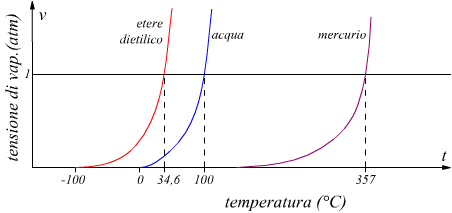
Come si vede dal grafico a temperatura ambiente (∼30°) l'acqua è già dotata di una certa tensione di vapore mentre l'etere dietilico sta già ampiamente evaporando. Il mercurio ha una tensione di vapore molto bassa a causa del forte legame metallico delle sue molecole. Riportiamo di seguito la tabella della pressione di vapore dell'acqua
| T [°C] | P[mmHg] |
| 0 | 4,6 |
| 5 | 6,5 |
| 10 | 9,2 |
| 15 | 12,8 |
| 20 | 17,5 |
| 25 | 23,8 |
| 30 | 31,8 |
| 35 | 42,2 |
| 40 | 55,3 |
| 45 | 71,9 |
| 50 | 92,5 |
| 55 | 118 |
| 60 | 149,4 |
| 65 | 187,5 |
| 70 | 233,7 |
| 75 | 289,1 |
| 80 | 355,1 |
| 85 | 433,6 |
| 90 | 525,8 |
| 95 | 633,9 |
| 100 | 760 |
Equazione di Clausius-Clapeyron
Se, come detto, l'energia cinetica media delle molecole aumenta all'aumentare
della temperatura si deduce che a temperature più elevate una maggior
percentuale di molecole in superficie sarà in grado di passare alla
fase gassosa. La tensione di vapore aumenta con la temperatura.
Questa dipendenza viene descritta dall'equazione di Clausius-Clapeyron
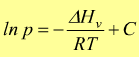
dove
ln p è
il logaritmo naturale della tensione di vapore
ΔHv è
il calore molare di evaporazione [ kJ/mol ]
R è
la costante universale dei gas 8,3145 [ J/mol°K ]
C è
una costante determinabile sperimentalmente per ogni composto.
Se per un dato liquido conosciamo il Δv e la tensione di vapore ad una certa temperatura è possibile determinare la tensione di vapore di quel liquido ad altre temperature.
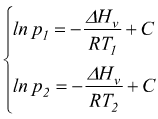 sottraendo
membro a membro
sottraendo
membro a membro
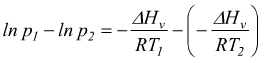
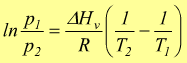
Esempio :
La tensione di vapore per l'etere dietilico è di 401 mmHg a 18°C e il
suo calore molare di evaporazione è di 26kJ/mol . Calcola la sua tensione
di vapore alla temperatura di 32°C.
Si ha
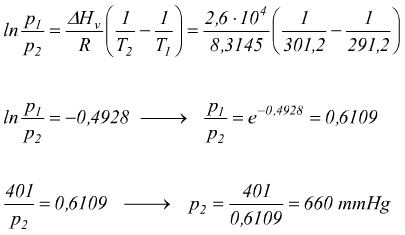
 edutecnica
edutecnica