Soluzioni
Una soluzione chimica è una miscela omogenea di due o più sostanze, in cui una sostanza (soluto) è disciolta in un'altra (solvente). Le soluzioni chimiche possono essere liquide, solide o gassose e vengono utilizzate in vari settori come la chimica, la farmaceutica, l'industria alimentare etc..
La concentrazione , esprime la quantità relativa dei soluti rispetto al solvente, può essere espressa nei seguenti modi:
— M molarità [ mol/l ] : numero di moli del soluto contenute in un litro di soluzione.
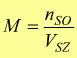 [
mol/l ]
[
mol/l ]
— m molalità [ mol/kg ] : numero di moli del soluto contenute in un chilogrammo di solvente.
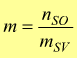 [
mol/kg ]
[
mol/kg ]
— N normalità [ eq/l ] : è il numero di equivalenti di soluto contenuti in un litro di soluzione.
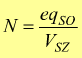 [
eq/l ] con
[
eq/l ] con 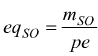
mSO= massa del soluto ( g )
pe=peso equivalente ( g/eq )
— χ frazione molare : è il rapporto tra le moli di un componente e la somma delle moli di tutti i componenti della soluzione. Per un unico soluto si ha:
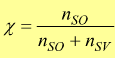
— percentuale in peso [ % ] : esprime la quantità in peso del soluto contenute in 100 parti di peso della soluzione ( l'unità di misura è il grammo ). Per un unico soluto:
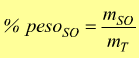 con
con ![]() (
le masse sono additive ).
(
le masse sono additive ).
— percentuale in volume [ % volume ] : è il volume del soluto in 100 parti i volume della soluzione (l'unità di misura è il millilitro). Per un unico soluto:
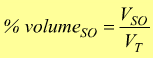 con
con ![]() (
i volumi non sono additivi ).
(
i volumi non sono additivi ).
Avendo indicato convenzionalmente con i pedici
SO : il soluto
SV : il solvente
SZ : la soluzione
Massa equivalente
Il grammo-equivalente ( o equivalente: eq ) è una quantità in grammi pari al peso-equivalente; questo si ottiene dividendo il peso molecolare ( pesoformula ) di una sostanza per un numero intero opportunamente scelto, corrispondente al numero di elettroni o protoni che una molecola di quella sostanza cede o acquista in determinate reazioni.
Peso equivalente di acidi e di basi
E' dato dal rapporto fra il pesoformula (PM) della specie ed il numero
di protoni ( H+ ) che essa può cedere
( se acido ) o accettare ( se base ). Se prendiamo ad esempio l'acido
solforico, esso può cedere due protoni.
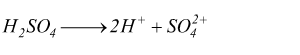
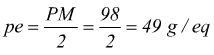
L'ammoniaca è una base che può accettare un protone.
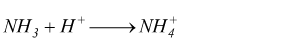
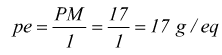
Peso equivalente di ossidanti e riducenti
E' dato dal rapporto fra il pesoformula (PM) della specie ed il numero di elettroni da essa messi in gioco nella reazione redox considerata. Ad esempio nella seguente reazione:
![]()
![]() lo
zinco si ossida
lo
zinco si ossida
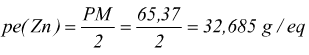
Peso equivalente di sostanze ioniche
E' dato dal rapporto fra il pesoformula ( PM ) della specie ionica e il numero delle sue cariche:
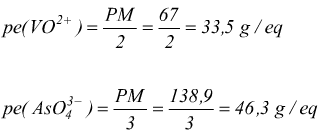
Peso equivalente di di elettroliti
E' dato dal rapporto fra il pesoformula ( PM ) della specie ed il numero totale di cariche dello stesso segno che si hanno nella dissociazione:
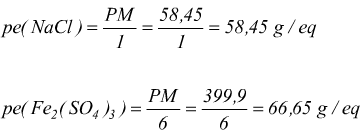
Ritornando alla definizione di normalità è facile dedurre la formula:
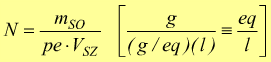
dove
mSO=massa del soluto in grammi.
pe=massa equivalente in g/eq
VSZ=volume della soluzione in l.
 edutecnica
edutecnica