Legame chimico
La formazione di legami tra due o più atomi per dare una molecola è
possibile se la molecola che si forma è più
stabile rispetto agli atomi isolati che la costituiscono.
Alla formazione del legame contribuiscono gli
elettroni più esterni di un atomo, i cosidetti elettroni di valenza.
Questi sono gli elettroni in eccesso rispetto alla configurazione del
gas nobile che precede l'atomo (i restanti elettroni costituiscono il
cosidetto nocciolo ell'atomo) e hanno numero quantico principale n,
il più grande possibile.
Gas nobili
Gli elementi che si si trovano nella colonna più a destra della tavola
periodica, sono i gas nobili: elio (He) neon (Ne) argon (Ar) kripto
(Kr) xenon (Xe) radon (Rn).
I gas nobili, sono posti ciascuno alla fine di un periodo del sistema
periodico e non entrano normalmente in reazione con nessun altro elemento:essi
sono estremamente stabili .
Questa peculiarità è causata dal fatto chei gas nobili, hanno nello
strato più esterno il massimo numero di orbitali possibili e ciascuno
di questi orbitali è occupato da due elettroni accoppiati (orbitale
saturo).
Come si vede nella tabella ad eccezione dell'elio (che è piccolo) tutti
gli altri elementi hanno nel loro strato elettronico più esterno otto
elettroni (completano l'ottetto).
| el. | n.at. | num.elettroni negli strati | Configurazione elettronica | |||||||||
|
K 1s |
L 2s2p |
M 3s3p3d |
N 4s4p4d4f |
O 5s5p5d5f |
P 6s6p6d |
|||||||
| He | 2 | 2 | 1s2 | |||||||||
| Ne | 10 | 2 | 8 | K | 2s22p6 | |||||||
| Ar | 18 | 2 | 8 | 8 | K | L | 3s23p6 | |||||
| Kr | 36 | 2 | 8 | 18 | 8 | K | L | M | 4s24p6 | |||
| Xe | 54 | 2 | 8 | 18 | 18 | 8 | K | L | M | 4s24p64d10 5s25p6 | ||
| Rn | 86 | 2 | 8 | 18 | 32 | 18 | 8 | K | L | M | N | 5s25p65d10 6s26p6 |
Gli atomi per quanto siano elettricamente neutri non sono in generale chimicamente stabili.
La stabilità di un elemento chimico è connessa
a due fatti:
1) l'acquisizione del massimo numero possibile (uno o quattro) di orbitali
elettronici nello stato più esterno.
2) con la saturazione della capacità di ricezione elettronica di tali
orbitali che, come sempre è di due elettroni.
Queste sono le due necessità fondamentali degli atomi.
La configurazione elettronica dei gas nobili risponde a questi due requisiti.
Perché si formi una molecola è quindi necessario che la sua stabilità dal punto di vista elettronico, risulti maggiore di quella degli elementi (atomi) che la costituiscono.
Gli atomi contribuiscono alla stabilità della molecola in tre modi:
• cedendo elettroni
• acquistando elettroni
• mettendo in comune elettroni
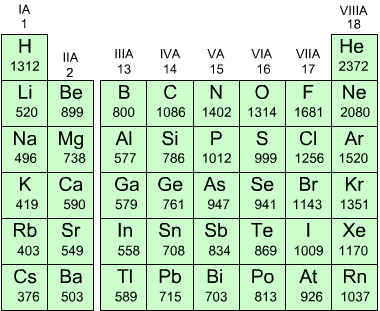
Energia di ionizzazione
L'energia di ionizzazione EI [ kJ/mol ] è l'energia minima richiesta per rimuovere un elettrone da un atomo in fase gassosa ad es. il litio ha una energia di 520kJ/mol quindi l'energia richiesta per far avvenire la reazione
![]()
è di 520kJ/mol. Bisogna specificare che questa è l'energia di prima
ionizzazione, infatti bisogna distinguere tra prima, seconda e terza
ionizzazione (EI1 EI2 EI3) a secondo
che si tratti di allontanare un solo o due o tre elettroni dall'atomo.
Se si aggiunge un elettrone ad un atomo si forma uno ione che è più
grande dell'atomo neutro originario.
Allontanando un elettrone da un atomo si forma uno ione che è più piccolo
dell'atomo neutro originario.
Quando vengono tolti elettroni, le repulsioni elettrone-elettrone diminuiscono
determinando un maggior avvicinamento degli elettroni rimasti che risulteranno
più attratti al nucleo.
Qui di fianco i valori di EI1 per alcuni elemento
In generale, all'aumentare del numero atomico, l'energia di ionizzazione aumenta lungo un periodo e diminuisce lungo un gruppo.
Affinità elettronica
L'affinità elettronica AE [ kJ/mol ] è la quantità di energia (in pratica
un'entalpia ΔH) che viene ceduta o acquistata quando un atomo
neutro e gassoso acquista un elettrone.
Alcuni atomi tendono ad acquistare spontaneamente un elettrone formando
ioni negativi (anioni) più stabili dell'atomo neutro originario. Ad
esempio quando il fluoro acquista un elettrone
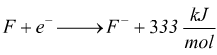 viene
liberata una energia di -333 KJ/mol
viene
liberata una energia di -333 KJ/mol
Questa energia (per un generico elemento che chiamiamo A) può avere
• segno positivo: processo endotermico (A+e- →
A-+AE)
• segno negativo: processo esotermico (A+e-+AE
→ A-)
 Energie di
ionizzazione molto elevate e valori di affinità molto bassi e positivi
sono presentati dai gas nobili (gruppo 18) che non tendono ne a cedere
ne ad acquistare elettroni.
Energie di
ionizzazione molto elevate e valori di affinità molto bassi e positivi
sono presentati dai gas nobili (gruppo 18) che non tendono ne a cedere
ne ad acquistare elettroni.
Gli alogeni (gruppo 16) hanno energie di ionizzazione elevate ed affinità
elettroniche fortemente negative. Hanno scarsa tendenza a cedere elettroni
e dunque nei loro composti ionici formano ioni negativi.
I metalli alcalini (gruppo 1) hanno energie di ionizzazione basse ed
affinità elettroniche basse e negative; mentre i metalli alcalinoterrosi
(gruppo 2) hanno energie di prima e seconda ionizzazione ed affinità
elettroniche positive.
Questi elementi , hanno tendenza a perdere elettroni e nei loro composti
ionici formano ioni positivi.
Elettronegatività
L'elettronegatività Χ viene definita
come la misura della tendenza di un atomo ad attrarre verso di se gli
elettroni di legame che lo tengono unito ad un altro atomo in una molecola.
Gli elementi con elevata elettronegatività hanno una maggior tendenza
ad attrarre gli elettroni rispetto gli elementi con bassa elettronegatività.
L'elettronegatività è collegata alle nozioni di affinità elettronica
ed energia di ionizzazione .
Essa permette di individuare qual'è l'elemento del composto intorno
al quale gli elettroni di legame passano la maggior parte del loro tempo.
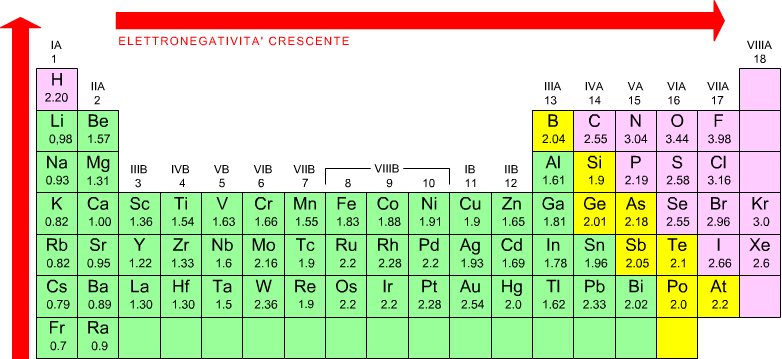
I valori di elettronegatività, indicati in tabella evidenziano che gli elementi di destra ( i non metalli) hanno i valori più alti di elettronegatività, cioè hanno grande tendenza ad acquistare elettroni, mentre gli elementi a sinistra della tabella ( metalli ) hanno valori inferiori di elettronegatività, quindi una notevole attitudine a cedere elettroni.
Quando due atomi si combinano per formare un legame, la loro elettronegatività determina il tipo di legame che si forma.
Un legame tra due elementi che presentano elettronegatività uguale
comparabile viene detto covalente ( ad es. tra atomi uguali, H2,
N2).
Un legame che si forma tra un elemento molto elettropositivo ed uno
molto elettronegativo viene detto ionico (ad es. NaCl).
Un legame tra elementi molto poco elettronegativi viene detto legame
metallico.
Questo tipo di legame implica che all'interno del cristallo del metallo,
gli elettroni sono liberi di muoversi tra un gran numero di atomi.
Orientativamente si può dire
ΔΧ >
2 legame ionico
Δ Χ < 0,5 legame covalente
apolare (puro)
0,5 ≤ Δ Χ ≤ 2 legame covalente
polare (con carattere intermedio tra i due precedenti).
Il legame ionico avviene sempre tra un atomo elettronegativo ed un
atomo elettropositivo.
Il legame covalente avviene tra atomi con elettronegatività uguale o
confrontabile.
primo elemento
secondo elemento
elettronegatività primo elemento
elettronegatività secondo elemento
tipo di legame
ΔΧ
Legame ionico
Il legame ionico si ha quando si incontrano un atomo A con bassa energia
di ionizzazione ed un atomo B con alta affinità elettronica . I due
elementi, si scambiano uno o più elettroni diventando ioni carichi;
in seguito a questo spostamento elettronico, l'atomo A si carica positivamente
e B negativamente.
Tra A e B si instaura una forza di tipo coulombiano che stabilizza il
legame ionico.
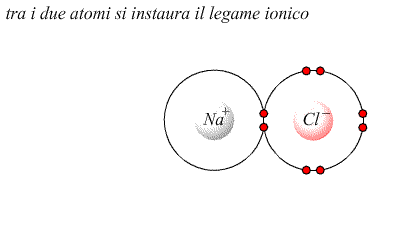
Ad es. quando cloro gassoso interagisce col sodio gassoso avviene la
seguente reazione
![]()
tra il catione Na+ e l'anione Cl- si manifesta attrazione elettrica (coulombiana) dato che sono ioni carichi di segno opposto.
Legame covalente
Il legame covalente, nasce dalla condivisione di elettroni tra due elementi che hanno elettronegatività uguale o comparabile; il più semplice legame che può essere considerato è quello dell'idrogeno molecolare H2 che si forma tra due atomi di idrogeno.
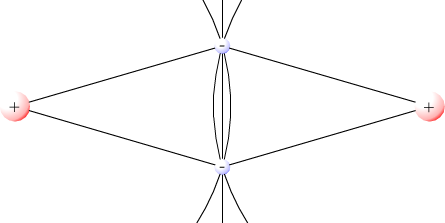
Le forze repulsive tra i protoni possono essere ridotte al minimo se la coppia di elettroni che formano il legame si trova tra i due nuclei. Dato che la distanza di ogni elettrone dai due nuclei è inferiore alla distanza tra i due nuclei, la forza di attrazione tra gli elettroni ed i nuclei risulta maggiore della forza di repulsione tra i due nuclei e tra i due elettroni. Si viene dunque a creare tra i due nuclei una regione in cui è concentrata la densità elettronica per la formazione del legame. Qui sotto, trascinando due atomi di cloro, che hanno sul loro orbitale più esterno 7 elettroni di valenza, si può formare un legame covalente per la formazione di una molecola Cl2.
 edutecnica
edutecnica